Boyle'i–Mariotte'i seadus (PV = k): ideaalgaasi definitsioon ja näide
Boyle'i–Mariotte'i seadus (PV = k) selgitatud lihtsate näidete ja ideaalgaasi definitsiooniga — õppige, kuidas rõhk ja ruumala pöördvõrdelised.
Boyle'i seadus (tuntud ka kui Mariotte'i seadus või Boyle'i–Mariotte'i seadus) on seadus ideaalsete gaaside käitumise kohta isothermsetes (konstandsel temperatuuril toimuvates) protsessides ning fikseeritud gaasimassi korral.
Seaduse sõnastus
Seaduse võib esitada nii sõnaliselt kui matemaatiliselt:
Fikseeritud temperatuuril hoitava ideaalse gaasi kindla koguse puhul on P (rõhk) ja V (ruumala) pöördvõrdelised.
See tähendab, et konstantse massiga ideaalse gaasi ruumala on pöördvõrdeline sellele rakendatud rõhuga, kui temperatuur ei muutu.
Sümbolites:
P ∝ 1 V {\displaystyle P\propto {\frac {1}{V}}}
või vastavalt:
P V = k {\displaystyle PV=k}
kus P on gaasi rõhk, V on gaasi ruumala ja k on konstant (konstandi väärtus sõltub gaasi kogusest ja temperatuurist).
Täiendav selgitus ja seos ideaalse gaasi seadusega
Boyle'i seadus on erijuht, mis kehtib, kui temperatuur ja gaasi mass on konstantsed. Üldisemalt kirjeldab ideaalse gaasi käitumist ideaalgaasi seadus:
PV = nRT, kus n on ainehulk (molides) ja R on universaalne gaasikonstant. Isotermse protsessi korral (T = konstant) on nRT konstant, seega PV = k.
Mikroskoopiline seletus
Makroskoopiliselt tähendab seadus seda, et kui ruumala väheneb (samas temperatuuris ja sama osakeste arvuga), siis osakeste kokkupõrgete sagedus seintega suureneb ja sellest tulenevalt suureneb ka rõhk. Kinetilise gaasimudeli vaatenurgast on rõhk tingitud osakeste impulsiülekannetest seintele — väiksemas mahus on ühtlase osakeste arvu korral pöördeliselt rohkem kokkupõrkeid ühe ühiku pinna kohta.
Rakendused ja piirangud
- Boyle'i seadust kasutatakse paljudes praktilistes ülesannetes ja mõõtmistes, näiteks oftalmoloogias (sügavuse- ja survemõõtmised), kompressiooniprotsesside analüüsis ja laborikatsetes.
- Seadus kehtib ideaalse lähedase käitumisega gaaside korral: madalatel rõhkudel ja mõõtmetelt kõrgel temperatuuril. Suurtel rõhkudel või lähedal kondenseerumise tingimustele (madal temperatuur, suur tihedus) hakkavad reaalsed gaasid deviatsiooni näitama ning tuleb kasutada reaalseid gaasimudeleid (nt van der Waals'i võrrandit).
- Arvestada tuleb, et rõhk peab olema absoluutne rõhk (Pa, atm, mmHg vms), mitte ainult manomeetriline näitaja, kui selle nullpunkti erinevus on oluline.
Näide
Oletame, et teil on gaas algtingimustel rõhk P1 = 3 atm ja ruumala V1 = 5 liitrit. Kui rõhku muutub P2 = 2 atm, siis isotermse protsessi puhul leiab lõpliku ruumala V2 Boyle'i seadusest:
P 1 V 1 = P 2 V 2 {\displaystyle P_{1}V_{1}=P_{2}V_{2}}}
V 2 = P 1 V 1 P 2 {\displaystyle V_{2}={\frac {P_{1}V_{1}}{P_{2}}}}
V 2 = 3 ∗ 5 2 {\displaystyle V_{2}={\frac {3*5}{2}}}
V 2 = 15 2 {\displaystyle V_{2}={\frac {15}{2}}}}
V 2 = 7.5 {\displaystyle V_{2}=7.5}
Tulemuseks: ruumala suureneb kuni V2 = 7,5 liitrit, kuna rõhu vähenemine poole võrra põhjustab ruumala ligikaudse kahekordistumise (seadusest tulenevalt pöördvõrdeline suhe).
Ajalugu
Seaduse esimesed katselised ja teoreetilised märkimisväärsed tulemused seostuvad Robert Boyle'i töödega 1662. aastal; iseseisev ja sarnase seaduspära kinnitamine seostub ka prantsuse teadlase Edme Mariotte'iga (1679).
Kokkuvõte
Boyle'i–Mariotte'i seadus: isotermses protsessis ja konstantsel gaasimassil kehtib PV = konstant ehk P ∝ 1/V. See on lihtne, kuid tähtis erijuht üldisemast ideaalse gaasi seadusest ning annab intuitiivse seletuse, miks rõhk ja ruumala omavahel pöördvõrdelised on.
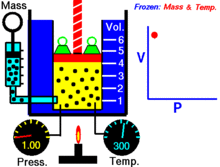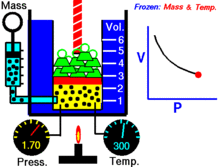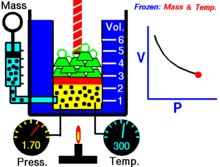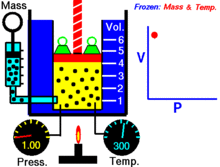
Animatsioon, mis näitab rõhu ja mahu suhet.Gaasi kogus ja temperatuur on konstantsed.
Küsimused ja vastused
K: Mis on Boyle'i seadus?
V: Boyle'i seadus (nimetatakse ka Mariotte'i seaduseks ja Boyle'i-Mariotte'i seaduseks) on seadus ideaalsete gaaside kohta, mis väidab, et konstantsel temperatuuril hoitava ideaalse gaasi kindla koguse puhul on rõhk (P) ja ruumala (V) pöördvõrdelised.
Küsimus: Kuidas saab Boyle'i seadust matemaatiliselt väljendada?
V: Boyle'i seadust saab matemaatiliselt väljendada järgmiselt: P ∝ 1/V või PV = k, kus P on gaasi rõhk, V on gaasi ruumala ja k on konstant.
K: Kes avastas selle seaduse?
V: Seaduse leidis 1662. aastal Robert Boyle ja seejärel iseseisvalt Edme Mariotte 1679. aastal.
K: Mida tähendab, kui ütleme, et P ja V on pöördvõrdelised?
V: See tähendab, et kui üks neist suureneb, väheneb teine proportsionaalselt - seega, kui vähendada teatava rõhu juures teatavat gaasikogust sisaldava mahuti mahtu, siis suureneb rõhk tänu osakeste vaheliste kokkupõrgete suurenemisele, mis tuleneb sellest, et nad asuvad väiksemas ruumis.
K: Kuidas kasutada Boyle'i seadust rõhu või mahu muutuste arvutamiseks?
V: Boyle'i seadust saame kasutada rõhu või mahu muutuste arvutamiseks, kasutades kahte võrrandit - P1V1=k ja P2V2=k -, kus k jääb konstantseks, samas kui kas P1/V1 või P2/V2 muutub sõltuvalt sellest, mida püütakse arvutada.
K: Kas seda seadust saab rakendada ka reaalsete gaaside puhul?
V: Ei - see kehtib ainult ideaalsete gaaside kohta, kuna neil puuduvad molekulidevahelised jõud.
Otsige






