Keemiline reaktsioon: definitsioon, tüübid, näited ja energiamuutused
Avasta keemiline reaktsioon: definitsioon, tüübid, näited ja energiamuutused — eksotermsed ja endotermsed protsessid selgitatud lühidalt.
Keemiline reaktsioon toimub siis, kui üks või mitu kemikaali muutub üheks või mitmeks teiseks kemikaaliks. Näited:
- raua ja hapniku ühendumine rooste moodustamiseks
- äädika ja söögisooda ühendamisel tekivad naatriumatsetaat, süsinikdioksiid ja vesi.
- põlevad või plahvatavad asjad
- paljud reaktsioonid, mis toimuvad elusolendite sees
- elektrokeemilised reaktsioonid akude tühjendamisel või laadimisel
Mõned reaktsioonid on kiired ja teised aeglased. Mõned toimuvad erineva kiirusega, sõltuvalt temperatuurist või muudest asjadest. Näiteks puit ei reageeri õhuga, kui see on külm, kuid kui see piisavalt kuumaks teha, hakkab see põlema. Mõned reaktsioonid annavad energiat. Need on eksotermilised reaktsioonid. Teistes reaktsioonides võetakse energiat sisse. Need on endotermilisedreaktsioonid.
Tuumareaktsioonid ei ole keemilised reaktsioonid. Keemilised reaktsioonid hõlmavad ainult aatomite elektrone; tuumareaktsioonid hõlmavad aatomituumade prootoneid ja neutroneid.
Mis on keemiline reaktsioon?
Keemiline reaktsioon on protsess, mille käigus tekivad või lõhustuvad kemikaalid, muutes ainete koostist ja omadusi. Reaktsioonis lõhutakse ja moodustatakse keemilisi sidemeid: sideme lõhkumiseks on vaja energiat, uute sidemete moodustamisel vabaneb energiat. Reaktsioonid kirjeldatakse sageli keemiliste võrrandite abil (näiteks CH4 + 2 O2 → CO2 + 2 H2O).
Peamised reaktsioonitüübid
- Liitmis- (sünteesi) reaktsioonid — kaks või enam ainet ühinevad üheks (A + B → AB).
- Lagundamis- (dekompositsiooni) reaktsioonid — üks aine laguneb mitmeks lihtsamaks (AB → A + B).
- Asendamisreaktsioonid — ühe aine osa asendub teisega; jagunevad ühe- ja kaheasendusreaktsioonideks (A + BC → AC + B).
- Double displacement (tuletamis) reaktsioonid — ioonide vahetus kahe ühendi vahel (AB + CD → AD + CB), sageli kaasneb sade või gaasi eraldumine.
- Redoksreaktsioonid — ühe aine oksüdeerub (kaotab elektrone) ja teine redutseerub (võtab elektrone); näide: raud oksüdeerub, moodustades rooste.
- Happelise-aluseline reaktsioon (protolyüs) — prootonide (H+) vahetus; hapete ja alustega seotud reaktsioonid.
- Polümerisatsiooni reaktsioonid — väikestest monomeeridest moodustuvad suured molekulid (plastide teke).
- Biokeemilised reaktsioonid — ensüümide juhitud protsessid rakkudes (näiteks fotosüntees, glükolüüs).
- Elektrokeemilised reaktsioonid — kaasnevad elektronide ülekandega läbi välise vooluahela, nt patareide ja akude töös (nt elektrokeemilised reaktsioonid akude tühjendamisel või laadimisel).
Energiamuutused: eksotermilised ja endotermilised reaktsioonid
Eksotermilised reaktsioonid vabastavad energiat ümbruskonda (temperatuur tõuseb), näiteks paljud põlemisreaktsioonid. Näide: metaani põlemine — CH4 + 2 O2 → CO2 + 2 H2O + energia.
Endotermilised reaktsioonid võtavad energiat sisse (temperatuur võib langea või tuleb soojus allikast), nt fotosünteesi protsess, kus päikesevalguse energia salvestub glükoosina (6 CO2 + 6 H2O + valgus → C6H12O6 + 6 O2).
Oluline mõiste on aktiveerimisenergia — minimaalne energia, mida osakestel on vaja, et reaktsioon saaks alata. Katalüsaator vähendab aktiveerimisenergiat, kiirendades reaktsiooni ilma ise püsivalt muutumata.
Reaktsioonikiirus ja millest see sõltub
- Temperatuur — kõrgem temperatuur suurendab osakeste liikumist ja kokkupõrke sagedust, tavaliselt kiirendab reaktsiooni.
- Kontsentratsioon — reagendi suurem kontsentratsioon suurendab kokkupõrgete tõenäosust.
- Pindala — tahkete ainete puhul suurendab peenestamine reaktsioonipinda ja kiirust.
- Rõhk — gaasireaktsioonide puhul mõjutab osakeste arv ruumühikus, seega ka kiirust.
- Katalüsaatorid — kiirendavad reaktsioone, vähendades aktiveerimisenergiat (nt ensüümid bioloogias, platina auto heitgaaside puhastites).
- Inhibiitorid — aeglustavad või peatavad reaktsioone.
Keemiline tasakaal
Paljud reaktsioonid on pööratavad: vahel moodustub tasakaal, kus reagendid ja produktid eksisteerivad pidevalt muutuvas suhtes, kuid makroskoopiliselt püsivad kontsentratsioonid konstantsetena. Seda kirjeldab tasakaalu konstant K. Le Chatelier' printsiip ütleb, et süsteem läheb kompenseerima välist muutust (nt kontsentratsiooni, temperatuuri või rõhu muutus) selleks, et osaliselt või täielikult neutraliseerida seda muutust.
Näited ja reaktsioonivõrrandid
- Äädika ja söögisooda (näide ülal): CH3COOH + NaHCO3 → CH3COONa + CO2↑ + H2O. (Tekib naatriumatsetaat, süsinikdioksiid ja vesi.)
- Raud ja hapnik (rooste): 4 Fe + 3 O2 → 2 Fe2O3 (lihtsustatud näide; tegelikus roostetamises osalevad ka vesi ja hüdraatatsioon).
- Põlemine: C3H8 + 5 O2 → 3 CO2 + 4 H2O + energia (propaani põlemine).
- Fotosüntees: 6 CO2 + 6 H2O + valgus → C6H12O6 + 6 O2 (energia salvestamine glükoosis).
- Keemiline korrosioon ja elektrokeemia: patareides toimuvad oksüdatsiooni-redutseerimisprotsessid, mis genereerivad elektrivoolu.
Katalüüsi ja ensüümid
Katalüsaatorid ei muuda reaktsiooni tasakaalu, vaid kiirendavad tasakaalu saavutamist. Bioloogias on katalüsaatoriteks ensüümid — valgud, mis suurendavad spetsiifiliselt biokeemiliste reaktsioonide kiirust, võimaldades rakkudel toimida madalamatel temperaturidel ja kitsamates tingimustes.
Tuumareaktsioonide eristus
Nagu algtekstis mainitud, tuumareaktsioonid ei ole keemilised reaktsioonid — need hõlmavad aatomituuma muundumist, prootonite ja neutronite arvu muutumist ning nendega kaasnevad palju suuremad energiaeraldused (näiteks tuumaenergia ja radioaktiivne lagunemine).
Ohutus ja praktiline tähendus
Keemilised reaktsioonid on igapäevaelus olulised: toiduvalmistamine, puhastamine, meditsiin, tööstus ja energeetika sõltuvad neist protsessidest. Samas tuleb arvestada ohtudega — mõned reaktsioonid on väga eksotermilised, teised tekitavad mürgiseid gaase või plahvatusohtu. Hea praktika on teha katseid hästi ventileeritavas ruumis ja järgida ohutusjuhiseid.
Kokkuvõte: Keemiline reaktsioon tähendab aine koostise muutust läbi keemiliste sidemete ümberpaigutuse. Reaktsioonide liike, kiirust ja energiamuutusi määravad faktorite nagu temperatuur, kontsentratsioon, katalüsaatorid ja rõhk. Tuumareaktsioonid erinevad fundamentaalselt keemilistest protsessidest, hõlmates tuuma osakeste muutusi.

Roostes raud

Lõkketuli on näide redoksist
Neli põhitüüpi
Süntees
Sünteesireaktsioonis ühinevad kaks või enam lihtsat ainet, et moodustada keerukamat ainet.
A + B ⟶ A B {\displaystyle A+B\longrightarrow AB}
"Kaks või enam reageerivat ainet annavad ühe toote" on teine viis sünteesireaktsiooni identifitseerimiseks. Üks näide sünteesireaktsioonist on raua ja väävli ühendamine raud(II)-sulfiidi moodustamiseks:
8 F e + S 8 ⟶ 8 F e S {\displaystyle 8Fe+S_{8}\longrightarrow 8FeS}
Teine näide on lihtne vesinikgaas, mis ühendatakse lihtsa hapnikuga, et saada keerukamat ainet, näiteks vett.
Lagundamine
Lagunemisreaktsioon on see, kui keerulisem aine laguneb oma lihtsamateks osadeks. See on seega sünteesireaktsiooni vastand ja seda võib kirjutada järgmiselt:
A B ⟶ A + B {\displaystyle AB\longrightarrow A+B}
Üks näide lagunemisreaktsioonist on vee elektrolüüs hapniku ja vesinikugaasi saamiseks:
2 H 2 O ⟶ 2 H 2 + O 2 {\displaystyle 2H_{2}O\longrightarrow 2H_{2}+O_{2}}}
Ühekordne asendamine
Ühe asendusreaktsiooni puhul asendab üks ühendis olev ühendamata element teise elemendi; teisisõnu, üks element vahetab ühendis teise elemendi vastu:
A + B C ⟶ A C + B {\displaystyle A+BC\longrightarrow AC+B}
Üks näide ühekordse väljatõrjumisreaktsiooni kohta on see, kui magneesium asendab vees vesiniku, mille tulemusena tekib magneesiumhüdroksiid ja vesinikgaas:
M g + 2 H 2 O ⟶ M g ( O H ) 2 + H 2 {\displaystyle Mg+2H_{2}O\longrightarrow Mg(OH)_{2}+H_{2}}}
Topelt asendamine
Topeltasendusreaktsioonis vahetavad kahe ühendi anioonid ja katioonid kohad ja moodustavad kaks täiesti erinevat ühendit. Need reaktsioonid on üldises vormis:
A B + C D ⟶ A D + C B {\displaystyle AB+CD\longrightarrow AD+CB}
Näiteks kui baariumkloriid (BaCl2 ) ja magneesiumsulfaat (MgSO4 ) reageerivad, vahetab SO42− anioon kohad 2Cl− aniooniga, andes ühendid BaSO4ja MgCl 2.
Teine näide kahekordse väljatõrjumise reaktsioonist on plii(II)nitraadi reaktsioon kaaliumjodiidiga, mille käigus moodustub plii(II)jodiid ja kaaliumnitraat:
P b ( N O 3 ) 2 + 2 K I ⟶ P b I 2 + 2 K N O 3 {\displaystyle Pb(NO_{3})_{2}+2KI\longrightarrow PbI_{2}+2KNO_{3}}}
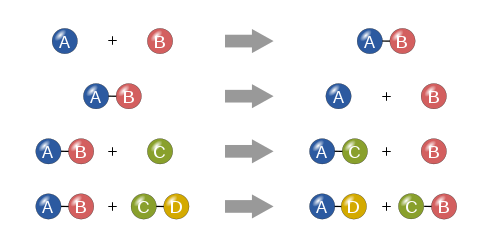
Neli põhilist keemilist reaktsiooni: süntees, lagundamine, ühekordne asendamine ja kahekordne asendamine.
Võrrandid
Keemilist reaktsiooni näitab võrrand:
A + B ⟶ C + D {\displaystyle \mathrm {A+B\longrightarrow C+D} }
Siin reageerivad A ja B keemilises reaktsioonis C ja D.
See on näide põlemisreaktsioonist.
C + O 2 ⟶ C O 2 {\displaystyle \mathrm {C+O_{2}\longrightarrow CO_{2}} }
Seotud leheküljed
- Orgaaniline reaktsioon
- Redox
Küsimused ja vastused
K: Mis on keemiline reaktsioon?
V: Keemiline reaktsioon toimub siis, kui üks või mitu kemikaali muutub üheks või mitmeks teiseks kemikaaliks.
K: Kas te oskate tuua näiteid keemiliste reaktsioonide kohta?
V: Jah, mõned näited keemilistest reaktsioonidest on raua ja hapniku liitumine rooste moodustamiseks, äädika ja söögisooda liitumine naatriumatsetaadi moodustamiseks, süsinikdioksiidi ja vee liitumine, asjade põlemine või plahvatamine ning paljud reaktsioonid, mis toimuvad elusolendite sees, näiteks fotosüntees.
K: Kas kõik keemilised reaktsioonid on kiired?
V: Ei, mõned reaktsioonid on kiired ja teised aeglased. Mõned toimuvad erineva kiirusega, sõltuvalt temperatuurist või muudest asjadest.
K: Mis on eksotermiline reaktsioon?
V: Eksotermiline reaktsioon on reaktsioon, mis annab energiat välja.
K: Mis on endotermiline reaktsioon?
V: Endotermiline reaktsioon on reaktsioon, mis võtab energiat.
K: Kas tuumareaktsioone loetakse keemilisteks reaktsioonideks?
V: Ei, tuumareaktsioonid ei ole keemilised reaktsioonid. Keemilised reaktsioonid hõlmavad ainult aatomite elektrone; tuumareaktsioonid hõlmavad aatomituumade prootoneid ja neutroneid.
K: Kas temperatuur võib mõjutada keemilise reaktsiooni kiirust?
V: Jah, sõltuvalt temperatuurist või muudest asjadest võivad mõned reaktsioonid toimuda erineva kiirusega. Näiteks puit ei reageeri õhuga, kui see on külm, kuid kui see piisavalt kuumaks teha, hakkab see põlema.
Otsige









