Süsinikdioksiid (CO2) – mis see on, omadused ja kliimamõju
Süsinikdioksiid (CO2): mis see on, omadused, fotosüntees, kuidas tekib ja kuidas kasvuhooneefekt mõjutab kliimat ning mida teha heitmete vähendamiseks.
Süsinikdioksiid (CO2) on keemiline ühend. See on toatemperatuuril gaas. See koosneb ühest süsiniku- ja kahest hapniku aatomist. Inimesed ja loomad eraldavad süsinikdioksiidi, kui nad hingavad välja. Samuti tekib süsinikdioksiidi iga kord, kui midagi orgaanilist põletatakse (või tehakse tulekahju). Taimed kasutavad süsinikdioksiidi toidu valmistamiseks. Seda protsessi nimetatakse fotosünteesiks. Süsinikdioksiidi omadusi uuris 1750. aastatel šoti teadlane Joseph Black.
Süsinikdioksiid on kasvuhoonegaas. Kasvuhoonegaasid seovad soojusenergiat. Kasvuhoonegaasid muudavad meie planeedi Maa kliimat ja ilma. Seda nimetatakse kliimamuutuseks. Kasvuhoonegaasid põhjustavad globaalset soojenemist, Maa pinnatemperatuuri tõusu.
Füüsikalised ja keemilised omadused
Süsinikdioksiid on lõhnatu, maitsetu ja värvusetu gaas, mis on atmosfääris tavatingimustes gaasilises olekus. See on õhust tihedam (umbes 1,5 korda), mistõttu kipub raskem gaas kogunema madalamatesse kohtadesse. Standardrõhul (1 atm) sublimiseerub tahke süsinikdioksiid ehk kuivjääk umbes −78,5 °C juures; vedelaks muutub ainult kõrge rõhu all (kriitiline punkt umbes 31 °C ja ~73,8 atm). Vees on CO2 suhteliselt hästi lahustuv: osa gaasist reageerib veega ja moodustab nõrgema süsinikhappe (H2CO3), mis omakorda mõjutab vee pH-d ja põhjustab, et ookeani veetase muutub happelisemaks (vaata allpool).
Kus CO2 tekib ja kust see kaob
CO2 on looduslikult osa süsihappe- ja süsinikutsüklist. Looduslikud allikad on näiteks hingamine (loomad ja mikroorganismid), orgaanilise aine lagunemine, maavara lagunemine ning vulkaanid. Inimtekkelised allikad hõlmavad fossiilkütuste (nafta, kivisüsi, maagaas) põletamist, tööstusprotsesse (näiteks tsementitootmine) ja metsade raiumist. Söövitajaks on ka maakasutuse muutused, mis vähendavad fotosünteesi kaudu siduvaid puid ja taimi.
CO2 viibivad osad atmosfääris väga kaua: osa CO2-st eemaldub mõne aastakümne jooksul taimede ja pinnase kaudu, kuid suur osa võib jääda atmosfääri sajadeks kuni tuhandeteks aastateks, kuna süsiniku jaotumine ookeanis ja maapõues toimub aeglaselt.
Kliimamõju ja globaalne kontsentratsioon
CO2 on üks peamisi inimmõjulisi kasvuhoonegaase, mis neelab infrapunakiirgust ja hoiab Maa pinnal soojust — see on oluline osa nii looduslikust kasvuhooneefektist kui ka sellest tekkivast täiendavast soojenemisest, mis on põhjustatud inimtegevusest. Enne industriaalajastut olid atmosfääri CO2 kontsentratsioonid ligikaudu 280 ppm (osakest miljonis). Tänapäeval on atmosfääriline CO2 kontsentratsioon üle 400 ppm (olenevalt mõõtmisaastast ja -kohtast), mis on oluliselt kõrgem kui mitu sajandit tagasi. Pidev kontsentratsioonide mõõtmine (näiteks Mauna Loa observatooriumis) näitab selget tõusu — seda mustrit tuntakse kui Keelingu kõverat.
Keskkonna- ja tervisemõjud
CO2-sisalduse kasv põhjustab mitmesuguseid keskkonnamuutusi: kliimasoojenemine, muutused sadememustrites, jää ja lumekattete vähenemine, meretaseme tõus ja sagedasemad ning intensiivsemad äärmuslikud ilmastikunähtused. Suurim kohene mõju ookeanile on ookeani happesuse suurenemine: lahustunud CO2 moodustab happeid, mis vähendavad karbonaatide kättesaadavust organismidele nagu korallid, teod ja mitmed planktoniliigid, kelle kestad või lestad sõltuvad kaltsiumkarbonaadist.
Tervisele on atmosfääriline CO2 tavapärastes kontsentratsioonides kahjutu. Suurenenud sisekeskkonna CO2 tase (näiteks halvasti ventileeritud ruumides) võib põhjustada väsimust, keskendumisraskusi ja peavalu. Väga kõrged kontsentratsioonid (tuhanded osakesed miljonis) võivad olla ohtlikud ja eluohtlikud.
Kasutusalad ja tööstus
- Toidu- ja joogitööstuses: gaseeritud joogid (karboniseerimine), külmaaine ja kuiva jää jahutusena.
- Tööstusprotsessid: keemiatööstuses toormaterjalina (nt uurea ja metanooli tootmisel), metallitööstuses keevitamisel ja tulekustutites.
- Põllumajanduses ja kasvuhoonetes kasutatakse mõnikord kontrollitud CO2-taset kasvutingimuste parandamiseks.
- Uued tehnoloogiad: otsepüüdmine õhust (direct air capture) ja CO2 mahapanek (CCS) on arenevad meetodid, mille eesmärk on vähendada atmosfääri jõudvat CO2-d.
Vähendamine ja lahendused
CO2-emissioonide vähendamiseks on mitmeid strateegiaid:
- Energia tootmise dekarboniseerimine — rohkem taastuvenergiat (tuule, päike), tõhusam elektrivõrk ja energiasääst.
- Transporti elektrifitseerimine ja kütuse efektiivsus.
- Metsade ja maastike kaitse ning taastamine, mis suurendavad bioloogilisi süsiniku sidujaid (looduslikud süsinikuvarud).
- Tööstusprotsesside süsiniku püüdmine ja hoiustamine (CCS), samuti tehnoloogiad, mis eemaldavad CO2 otse õhust.
- Tarbimise ja tootmise muutused: ringmajandus, materjalitõhusus ja toitumisharjumuste muutmine (nt vähem punast liha) võivad vähendada süsiniku jalajälge.
Kokkuvõte
Süsinikdioksiid on looduslikult esinev ja inimtegevuse tõttu atmosfääris suurenenud gaas, millel on oluline roll Maa energia tasakaalus. Selle kontsentratsiooni kasv mõjutab kliimat, ookeane ja ökosüsteeme ning nõuab ühiskondlikke ja tehnoloogilisi lahendusi emissioonide vähendamiseks ja süsiniku sidumiseks. Mõistmine, kuidas CO2 tekib, kuhu see läheb ning millised on selle tagajärjed, on vajalik jätkusuutlike otsuste tegemiseks.
Süsinikdioksiidi struktuurivalem. C on süsinik ja O on hapnik. Topeltjooned tähistavad aatomite vahelist kahekordset keemilist sidet.
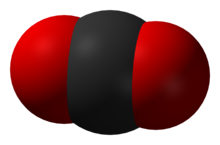
Pilt, mis näitab lihtsalt, kuidas aatomid võivad täita ruumi. Must on süsinik ja punane on hapnik.
Bioloogiline roll
Süsinikdioksiid on lõppsaadus organismides, mis saavad energiat suhkrute, rasvade ja aminohapete lagundamisest hapniku abil ainevahetuse käigus. Seda protsessi nimetatakse rakuhingamiseks. Siia kuuluvad kõik taimed, loomad, paljud seened ja mõned bakterid. Kõrgemate loomade puhul liigub süsihappegaas verega keha kudedest kopsudesse, kus see väljahingatakse. Taimed võtavad atmosfäärist süsihappegaasi, et kasutada seda fotosünteesi käigus.
Kuivjää
Kuivjää ehk tahke süsihappegaas on CO2 gaasi tahke olek, mis on temperatuuril alla -109,3 °F (-78,5°C). Kuivjää ei esine Maal looduslikult, vaid on inimtekkeline. See on värvitu. Inimesed kasutavad kuiva jääd, et muuta asju külmaks ja jooke gaseerituks, tappa rästikuid ja külmutada tüükaid. Kuiva jää aur põhjustab lämbumist ja lõpuks surma. Kuiva jää kasutamisel on soovitatav olla ettevaatlik ja kasutada professionaalset abi.
Tavalise rõhu all ei sulata see tahkest ainest vedelikuks, vaid muutub otse tahkest ainest gaasiks. Seda nimetatakse sublimatsiooniks. See muutub otse tahkest ainest gaasiks mis tahes temperatuuril, mis on kõrgem kui väga külm temperatuur. Kuivjää sublimeerub tavalisel õhutemperatuuril. Tavalise õhuga kokkupuutel eraldub süsinikdioksiidigaas, millel ei ole värvi. Süsinikdioksiid võib vedeldada rõhu all, mis ületab 5,1 atmosfääri.
Kuivast jääst eralduv süsihappegaas on nii külm, et õhuga segunedes jahutab ta õhus oleva veeauru uduks, mis näeb välja nagu paks valge suits. Seda kasutatakse sageli teatris, et tekitada udu või suitsu muljet.

Kuivjää, kui see pannakse vette
Isoleerimine ja tootmine
Keemikud saavad süsihappegaasi jahutusõhust. Nad nimetavad seda õhu destilleerimiseks. See meetod on ebaefektiivne, sest väikese koguse CO2 eraldamiseks tuleb jahutada suur kogus õhku. Keemikud võivad süsinikdioksiidi eraldamiseks kasutada ka mitmeid erinevaid keemilisi reaktsioone. Süsinikdioksiidi tekib enamiku hapete ja enamiku metallkarbonaatide vahelistes reaktsioonides. Näiteks soolhappe ja kaltsiumkarbonaadi (lubjakivi või kriit) vahelises reaktsioonis tekib süsinikdioksiid:
2 H C l + C a C O 3 ⟶ C a C l 2 + H 2 C O 3 {\displaystyle \mathrm {2\ HCl+CaCO_{3}\longrightarrow CaCl_{2}+H_{2}CO_{3}}} }
Seejärel laguneb süsihape (H2CO3) veeks ja CO2-ks. Sellised reaktsioonid põhjustavad vahutamist või mullitamist või mõlemat. Tööstuses kasutatakse selliseid reaktsioone palju kordi happevoogude neutraliseerimiseks.
Lubjakivi (CaO), mis on laialt levinud kemikaal, saab valmistada kuumutades lubjakivi umbes 850 °C-ni. Selle reaktsiooni käigus tekib ka CO2:
C a C O 3 ⟶ C a O + C O 2 {\displaystyle \mathrm {CaCO_{3}\longrightarrow CaO+CO_{2}} }
Süsinikdioksiidi tekib ka kõigi süsinikku sisaldavate kütuste, näiteks metaani (maagaas), naftadestillaatide (bensiin, diisel, petrool, propaan), kivisöe või puidu põletamisel. Enamasti eraldub ka vesi. Näiteks on metaani ja hapniku vaheline keemiline reaktsioon:
C H 4 + 2 O 2 ⟶ C O 2 + 2 H 2 O {\displaystyle \mathrm {CH_{4}+2\ O_{2}\longrightarrow CO_{2}+2\ H_{2}O} }
Süsinikdioksiidi toodetakse terasetehastes. Raua redutseeritakse selle oksiididest koos koksiga kõrgahjus, mille tulemuseks on malm ja süsinikdioksiid:
F e 2 O 3 + 3 C O ⟶ 2 F e + 3 C O 2 {\displaystyle \mathrm {Fe_{2}O_{3}+3\ CO\longrightarrow 2\ Fe+3\ CO_{2}} }
Pärm metaboliseerib suhkrut, et toota süsinikdioksiidi ja etanooli, mida tuntakse ka kui alkoholi, veinide, õlle ja muude kangete alkohoolsete jookide, aga ka bioetanooli tootmisel:
C 6 H 12 O 6 ⟶ 2 C O 2 + 2 C 2 H 5 O H {\displaystyle \mathrm {C_{6}H_12}O_6}\longrightarrow 2\ CO_2}+2\ C_2}H_5}OH} }
Kõik aeroobsed organismid toodavad CO
2, kui nad oksüdeerivad rakkude mitokondrites süsivesikuid, rasvhappeid ja valke. Sellega seotud suur hulk reaktsioone on äärmiselt keerulised ja neid ei ole lihtne kirjeldada. (Nende hulka kuuluvad rakuhingamine, anaeroobne hingamine ja fotosüntees). Fotoautotroofid (st taimed, tsüanobakterid) kasutavad teist reaktsiooni: Taimed neelavad CO
2 õhust ja reageerivad sellega koos veega, et moodustada süsivesikuid:
n C O 2 + n H 2 O ⟶ ( C H 2 O ) n + n O 2 {\displaystyle \mathrm {nCO_{2}+nH_{2}O\longrightarrow (CH_{2}O)n+nO_{2}}} }
Süsinikdioksiid on vees lahustuv, milles see muundub spontaanselt CO2 ja H
2CO
3 (süsihappeks). CO
2, H
2CO
3 ja deprootoniseeritud vormide HCO-
3 (bikarbonaat) ja CO2-
3 (karbonaat) sõltuvad happesusest (pH). Neutraalses või kergelt aluselises vees (pH > 6,5) domineerib bikarbonaatvorm (>50%), mis muutub merevee pH juures kõige enamlevinud (>95%), samas kui väga aluselises vees (pH > 10,4) on valdavaks (>50%) karbonaatvormiks karbonaat. Bikarbonaat- ja karbonaatvormid on väga hästi lahustuvad. Seega sisaldab õhuga tasakaalustatud ookeanivesi (kergelt aluseline, tüüpiline pH = 8,2-8,5) umbes 120 mg bikarbonaati liitri kohta.
Tööstuslik tootmine
Tööstuslik süsihappegaas tekib peamiselt kuue protsessi käigus:
- püüdes kinni looduslikud süsinikdioksiidi allikad, kus see tekib hapestunud vee toimel lubjakivile või dolomiidile.
- Vesiniku tootmisettevõtete kõrvalsaadusena, kus metaan muudetakse CO2-ks;
- Fossiilsete kütuste või puidu põletamisest;
- Suhkru käärimise kõrvalsaadusena õlle, viski ja muude alkohoolsete jookide valmistamisel;
- Lubjakivi termilisel lagundamisel tekib CaCO
3, lubja (kaltsiumoksiid, CaO) valmistamisel;
Keemiline reaktsioon
Süsinikdioksiidi saab luua lihtsa keemilise reaktsiooniga:
C + O 2 ⟶ C O 2 {\displaystyle \mathrm {C+O_{2}\longrightarrow CO_{2}} }
Küsimused ja vastused
K: Mis on süsinikdioksiid?
V: Süsinikdioksiid on keemiline ühend, mis on happeline, koosneb ühest süsinik- ja kahest hapniku aatomist ning on toatemperatuuril gaasiline.
K: Kuidas satub süsinikdioksiid atmosfääri?
V: Inimesed ja loomad eraldavad süsinikdioksiidi, kui nad hingavad välja ja iga kord, kui midagi orgaanilist põletatakse või tehakse tulekahju.
K: Mis on fotosüntees?
V: Fotosüntees on protsess, mille käigus taimed kasutavad süsinikdioksiidi toidu valmistamiseks.
K: Kes uuris süsinikdioksiidi omadusi?
V: Šoti teadlane Joseph Black uuris 1750. aastatel süsinikdioksiidi omadusi.
K: Mis on kasvuhoonegaas?
V: Kasvuhoonegaas on gaas, mis seob soojusenergiat ja muudab planeedi kliimat ja ilmastikut.
K: Kuidas aitab süsinikdioksiid kaasa kliimamuutustele?
V: Süsinikdioksiid on kasvuhoonegaas, mis aitab kaasa kliimamuutustele, kuna see püüab soojusenergiat ja põhjustab globaalset soojenemist, mis tähendab Maa pinnatemperatuuri tõusu.
K: Kuidas on süsinikdioksiidi kontsentratsiooni Maa atmosfääris reguleeritud?
V: Süsihappegaasi kontsentratsiooni Maa atmosfääris on reguleerinud fotosünteesivad organismid ja geoloogilised nähtused, peamiselt vulkaanid, alates prekambriumi ajastu lõpust.
Otsige






