Isolobaalanaloogia: definitsioon ja rakendused metallorgaanilises keemias
Isolobaalanaloogia: põhjalik ülevaade, definitsioon ja praktilised rakendused metallorgaanilises keemias — teooria, HOMO/LUMO-analüüs ja Hoffmanni panus.
Isolobaalpõhimõte (tuntud ka kui isolobaalanaloogia) on lihtne, kuid võimas kontsept, mida kasutatakse metallorgaaniliste ühendite side- ja reaktiivsuseomaduste ennustamiseks. Metallorgaanilises keemias seostab see orgaaniliste ligandide struktuuri anorgaaniliste või metalliliste molekulaarfragmentidega, lähtudes nende piirorbitaalide omadustest. Idee seisneb selles, et kaks fragmenti on isolobaalset kui neil on sarnane number piirorbitaale, nende sümmeetria, ligikaudne energia ja kuju ning ka piirorbitaalides olevate elektronide arv — mitte täiuslikult identsed, aga piisavalt sarnased, et ennustada sarnast sidumist ja reaktiivsust.
Roald Hoffmann kirjeldas molekulaarfragmente kui isolobaalseid, "kui piirorbitaalide arv, sümmeetriaomadused, ligikaudne energia ja kuju ning neis olevate elektronide arv on sarnased - mitte identsed, kuid sarnased". Põhimõte tugineb eelkõige molekulide kõrgeima hõivatud ja madalaima hõivamata molekulaarorbitaali (HOMO ja LUMO) omadustele: kui kahe fragmendi piirorbitaalid kattuvad ja nende HOMO/LUMO omadused on sarnased, võib oodata sarnaseid sidemeid ja reaktsioone. Isolobaalsed ühendid on analoogid isoelektroonilistele ühenditele, millel on sama arv valentselektroneid ja sarnane üldine keemiline käitumine, kuid isolobaalsus rõhutab eelkõige piirorbitaalide rolli.
Joonisel 1 on esitatud isolobaalsete struktuuride graafiline kujutis, kus isolobaalpaarid on ühendatud kahepealise noolega; kujutisel tähistatakse ka orbitaalide pooli ja nende orientatsiooni, et illustreerida, kuidas fragmendid omavahel kokku sobiksid.
Rakendused metallorgaanilises keemias
Isolobaalanaloogiat kasutatakse laialdaselt nii mõistete arendamisel kui ka praktiliste ennustuste tegemisel:
- Ligandide ja metalfragmentide võrdlemine: kui orgaaniline fragment (nt metüülradikaal) on isolobaalne teatud metalfragmentiga, võib metalfragment käituda sarnaselt orgaanilise fragmendiga sideme moodustamisel.
- Uute komplekside kavandamine: isolobaalsete analoogiate abil saab üle kanda tuntud sidumisviise ühest süsteemist teise ja nii ette näha võimalikud struktuurid metallosakeses või klastris.
- Katalüüsi ja reaktsiooniteede mõistmine: isolobaalanaloogia aitab selgitada, kuidas mõni metallfragment võib käituda teatud reaktsioonitingimustes ning suunata katalüütiliste tsüklite ja vaheainete tuvastamist.
- Klasterkeemia ja agregaatide süntees: isolobaalsete fragmentide ühendamisel saab ette näha klastrite ülesehitust ja võimalikku elektronide jaotust.
- Spektroskoopilise tõlgenduse abivahend: isolobaalsus annab heuristikat orbitaalsete omaduste ja seeläbi ka spektriliste tunnuste (nt UV/Vis, IR) seletamiseks, mida saab edasi kontrollida arvutuslike meetoditega.
Piirangud ja täiustused
Hoffmann ise rõhutas, et isolobaalanaloogia on kasulik, kuid lihtne mudel. Sellel on mitmeid piiranguid, mida teadlased lähtekohana silmas peavad:
- Qualitatiivsus: isolobaalsus annab sageli suuna või oletuse, kuid ei asenda kvantitatiivset arvutuskeemiat—täpseks energiakalkulatsiooniks ja reaktsiooniteede prognoosimiseks on vajalikud molekulaarse modelleerimise meetodid.
- Orbitaalienergiate erinevused: isegi kui orbitaalide kuju ja sümmeetria on sarnased, võivad nende energiatasemed erineda nii palju, et ennustused ei pea paika.
- Keskkonna- ja sterilised efektid: ligandid, lahustid, ioonne laeng ja ruumilised faktorid võivad oluliselt mõjutada sidumist, mida isolobaalanalüüs ei pruugi arvesse võtta.
- Erandid: on juhtumeid, kus isolobaalne võrdlus eksitab — eriti süsteemides, kus on tugev elektron-korrelatsioon, relativity mõjutused (raskemate elementide puhul) või spetsiifilised sidemeelemendid.
Tänapäeval kasutatakse isolobaalanaloogiat sageli koos arvutuskeemiaga (nt DFT) ja eksperimendiandmetega: mudel annab kiire heuristilise aluse ja arvutused kontrollivad seda ja annavad kvantitatiivse põhjenduse.
Oma töö eest isolobaalanaloogia alal pälvis Hoffmann 1981. aastal Nobeli keemiapreemia, mida ta jagas koos Kenichi Fukui'ga. Tema töö on jätnud püsiva pärandi keemias, olles nii õpetlikuks mõtteharjutuseks kui ka praktiliseks tööriistaks metallorgaaniliste ühendite uurimisel.
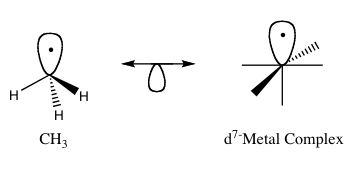
Joonis 1: Põhinäide isolobaalse analoogia kohta.
Küsimused ja vastused
K: Mis on isolobaalpõhimõte?
V: Isolobaalpõhimõte (tuntud ka kui isolobaalanaloogia) on viis, kuidas ennustada metallorgaaniliste ühendite sideomadusi. See seostab orgaaniliste ligandide struktuuri, mis võivad seonduda anorgaaniliste molekulifragmentidega, võrreldes nende kõrgeima hõivatud molekuliorbitaali (HOMO) ja madalaima hõivamata molekuliorbitaali (LUMO).
K: Kes pakkus välja isolobaalpõhimõtte?
V: Roald Hoffmann pakkus välja isolobaalpõhimõtte.
K: Kuidas on see seotud isoelektrooniliste ühenditega?
V: Isolobaalsed ühendid on analoogid isoelektrooniliste ühenditega, millel on sama arv valentselektroneid ja sama struktuur.
K: Mida Hoffmann sai selle kontseptsiooni väljatöötamise eest?
V: Oma töö eest isolobaalide analoogia alal sai Hoffmann 1981. aastal Nobeli keemiapreemia, mida ta jagas koos Kenichi Fukui'ga.
K: Kuidas kirjeldas Hoffmann molekulaarfragmente?
V: Hoffmann kirjeldas molekulaarfragmente kui isolobaalseid, "kui piirorbitaalide arv, sümmeetriaomadused, ligikaudne energia ja kuju ning neis olevate elektronide arv on sarnased - mitte identsed, kuid sarnased".
K: Kuidas saab seda mudelit kasutada sidumise ja reaktiivsuse ennustamiseks?
V: Võib ennustada vähemtuntud tükkide sidumist ja reaktiivsust paremini tuntud tükkide omast, kui neil on sarnased piirorbitaalid.
K: Kas see mudel töötab alati õigesti?
V: Ei, teatud juhtudel ei toimi.
Otsige