Mis on ligand? Biokeemia määratlus, funktsioonid ja afiinsus
Mis on ligand? Biokeemia mõiste, ligandide rollid, seondumine ja afiinsus: selgitused, näited (substraadid, inhibiitorid, neurotransmitterid) ning mõju retseptoritele.
Ligand on biokeemiline aine. Selle ülesanne on seonduda bioloogilise molekuliga ja panna see molekul täitma oma funktsiooni. Ligandi seondumine muudab retseptorvalgu kuju. See muudab valgu käitumist.
Kitsamas mõttes on see signaali vallandav molekul, mis seondub sihtvalgu mingi kohaga.
Sidumine toimub molekulidevaheliste jõudude, näiteks ioonsete sidemete, vesiniksidemete ja van der Waalsi jõudude abil. Dokkimine (assotsiatsioon) on tavaliselt pöörduv (dissotsiatsioon).
Ligandide hulka kuuluvad substraadid, inhibiitorid, aktivaatorid ja neurotransmitterid. Sidumise kalduvust või tugevust nimetatakse afiinsuseks.
Mis tüüpi ligandid on olemas?
- Endogeensed ligandid – keha enda valmistatud molekulid, näiteks hormoonid, neurotransmitterid ja kasvufaktorid.
- Eksogeensed ligandid – väljast sisse viidud ained, näiteks ravimid, toksiinid ja mõned toiduühendid.
- Agonistid ja antagonistid – agonist seob retseptori ja aktiveerib selle, antagonist seob retseptori, kuid ei aktiveeri seda ning takistab agonisti mõju.
- Partiaalsed agonistid – aktiveerivad retseptorit osaliselt, sõltuvalt tingimustest.
- Allosteerilised modulaatorid – seonduvad mitteaktiivse kohaga retseptoril ja muudavad tema afiinsust või aktiivsust.
Kuidas ligandid seonduvad? Mehhanismid ja jõud
Ligandide ja sihtmolekulide seondumine põhineb erinevatel intermolekulaarjõududel: ioonilised sidemed, vesiniksidemed, hüdrofoobsed interaktsioonid, pi‑pi kokkupuuted ning van der Waalsi jõud. Mõnikord võib ette tulla ka koordinaatsidet metalliiooniga või isegi kovalentset modifikatsiooni (näiteks aspiriin asetseerib koalvetselt COX‑ensüümi) — selline sidumine on sageli pöördumatu.
Seondumismudelite hulgas eristatakse kahte peamist kontseptsiooni: lukku‑võti (lock-and-key), kus ligand sobib hästi olemasolevasse sidumiskohta, ja indutseeritud kujumuutus (induced fit), kus valk muudab kuju vastuseks ligandi seondumisele. Paljudel juhtudel toimub kombineeritud mehhanism.
Afiinsus, spetsiifilisus ja kineetika
Afiinsus väljendab ligandi võimet seonduda sihtmolekuliga ja seda kirjeldatakse sageli dissotsiatsioonikonstandi Kd abil. Väike Kd tähendab kõrget afiinsust. Suhe kineetiliste parameetrite kaudu on:
Kd = koff / kon
kus kon on assotsiatsioonikiirus ja koff dissotsiatsioonikiirus. Ligandi ligikaudne seotuseosa antud ligandikontsentratsiooni juures (fraktsioon seondunud) annab lihtne seos:
fraktsioon = [L] / ([L] + Kd)
See selgitab, miks nii afiinsus kui ka ligandikontsentratsioon määravad, kui palju sihtmolekule on aktiivselt seondunud.
Allosteeria ja kooperatiivsus
Mõned valgud, näiteks hemoglobiin, näitavad kooperatiivset seondumist: ühe molekuli seondumine muudab teiste seondumise tõenäosust. Allosteerilised efekti põhjustavad ligandide seondumiskohad, mis paiknevad eraldi peamisest aktiivsest kohast ja reguleerivad valgufunktsiooni.
Näited
- Oksügeen ja hemoglobiin – hapniku sidumine hemoglobiini rauakeskmesse näitab kooperatiivset afiinsuse muutust.
- Neurotransmitterid – nt atsetüülkoliin või dopamiin seonduvad retseptoritega närvisüsteemis ning algatavad signaaliedastuse.
- Ravimid – paljud ravimid toimivad ligandidena, mis kas aktiveerivad või blokeerivad eesmärgitud valke (nt beeta‑blokkerid, atsetüülkoliini esteraasi inhibiitorid).
Kuidas afiinsust ja sidumist mõõdetakse?
- Radioligand‑seondumine (radioligand binding assays)
- Pinnaplasmonresonants (SPR) – määrab kon ja koff reaalajas
- Isotermiline titratsiooni kalorimeetria (ITC) – mõõdab termodünaamikat (ΔH, ΔS) ja Kd
- Fluorestsentsi anisotroopia ning muud fluorestsentsipõhised meetodid
Miks ligandite mõistmine on oluline?
Ligandid on võtmetähtsusega rakkudevahelises suhtluses, ainevahetuses ja ravimite toime kujunemises. Ligandide uurimine aitab mõista haiguste patofüsioloogiat, kujundada uusi ravimeid ning selgitada signaaliradade regulatsiooni. Mõistmine, kuidas afiinsus, spetsiifilisus ja kineetika koos toimivad, võimaldab ravimite optimeerimist ja täppissekkumisi bioloogilistes süsteemides.
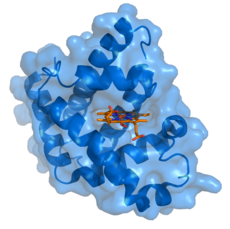
Müoglobiin (sinine) koos selle ligandiga heem (oranž), mis on seotud.
Seotud leheküljed
- Signaalide ülekandmine
- Tsütokiin
- Agonist
- Retseptori antagonist
Küsimused ja vastused
K: Mis on sidemelüli?
V: Ligand on biokeemiline aine, mis seondub bioloogilise molekuliga, et see täidaks oma funktsiooni.
K: Kuidas mõjutab ligandi seondumine retseptorvalku?
V: Ligandi seondumine muudab retseptorvalgu kuju, mis omakorda muudab valgu käitumist.
K: Kuidas toimub ligandi seondumine?
V: Ligandi seondumine toimub molekulidevaheliste jõudude, näiteks ioonsete sidemete, vesiniksidemete ja van der Waalsi jõudude kaudu.
K: Kas ligandi seondumine on pöörduv?
V: Jah, ligandi sidumine on tavaliselt pöörduv ja seda saab dissotsieerida.
K: Millised on mõned näited ligandide kohta?
V: Ligandide hulka kuuluvad substraadid, inhibiitorid, aktivaatorid ja neurotransmitterid.
K: Kuidas nimetatakse seondumise tendentsi või tugevust?
V: Sidumise kalduvust või tugevust nimetatakse afiinsuseks.
K: Mis on ligandi spetsiifiline funktsioon sihtvalkude suhtes?
V: Kitsamas mõttes on ligand signaalit vallandav molekul, mis seondub sihtvalgu konkreetsesse kohta.
Otsige