Molekul: määratlus, struktuur ja näited
Molekul: selge määratlus, aatomite struktuur, molekulaarvalem ja praktilised näited (nt glükoos). Kuidas molekulid käituvad gaasides, vedelikes ja tahketes — loe lähemalt.
Molekul on keemilise aine väikseim kogus, mis võib eksisteerida. Kui molekul jaguneks väiksemateks tükkideks, oleks see teistsugune aine.
Molekulid koosnevad aatomitest, mis on kokku kleebitud teatud kujul või kujul. Kõik aatomite kombinatsioonid ei ole võrdselt võimalikud; aatomid moodustavad teatud kujundeid eelistades teisi. Samuti on neil erinev valentsus. Näiteks hapniku aatomitel on alati kaks sidet teiste aatomitega, süsiniku aatomitel on alati neli sidet teiste aatomitega ja lämmastiku aatomitel on alati kolm sidet teiste aatomitega.
Gaaside kineetilises teoorias kasutatakse sageli mõistet molekul iga gaasilise osakese kohta, sõltumata selle koostisest. Selle määratluse kohaselt loetakse väärisgaasi aatomeid molekulideks, kuna nad on tegelikult monoatomaarsed molekulid.
Gaasides, näiteks õhus, lendavad molekulid lihtsalt ringi. Vedelikes, nagu vesi, on molekulid kokku kleepunud, kuid nad võivad siiski liikuda. Tahketes ainetes, nagu suhkur, saavad molekulid ainult vibreerida. Neljandas olekus,, mida nimetatakse plasmaks, on aatomid ioniseeritud ja ei saa moodustada molekule.
Molekulaarvalemi abil saate kirja panna kõigi molekuli aatomite arvud. Näiteks glükoosi molekulaarvalem on C6H12O6. See tähendab, et üks glükoosimolekul koosneb kuuest süsinikuaatomist, kaheteistkümnest vesinikuaatomist ja kuuest hapniku aatomist.
Struktuur ja keemilised sidemed
Molekulide sisesed sidemed on tavaliselt kovalentsed sidemed, kus aatomid jagavad elektrone. Sidemed võivad olla üksikud, kaksikud või kolmikud (näiteks C–C, C=C, C≡C) ning sideme tugevus ja pikkus sõltuvad nende tüübist. Sideme jaotus elektronide vahel määrab ka molekuli polaarsuse — kas molekulil on positiivne ja negatiivne ots (dipool) või on see mittepolaarne.
Lisaks kovalentsetele sidemetele esineb molekulidevahelisi jõude, mis mõjutavad aine füüsikalisi omadusi:
- London'i dispersioonjõud (kaasa arvatud van der Waals'i jõud) — kõikidel molekulidel olemas, tugevneb molekulide suuruse ja elektrituvuse kasvades;
- dipool-dipool — molekulidel, millel on püsiv dipool;
- vesiniksild — eriline tugev dipoolne interaktsioon, mis tekib näiteks vee molekulide vahel (H ühendatud O, N või F-ga).
Molekulide kuju ja geomeetria
Molekulide kolmemõõtmeline kuju määrab palju nende keemilisi ja füüsikalisi omadusi. Geomeetriat ennustatakse sageli VSEPR‑teooria (valentspaaride tõrje) abil, mis arvestab elektronpaaride vastastikust tõrget. Näiteks veemolekul on kumer (nurgaga) ja süsinikuga seotud nelja sidemega aatom (nt CH4) on tetraeedriline. Molekulide ruumiline paigutus on tähtis ka reaktsioonikiiruste ja selektiivsuse mõistmisel.
Molekulide olekud ja omadused
Nagu eespool mainitud, käituvad molekulid erinevalt sõltuvalt olekust:
- Gaasides liiguvad molekulid vabal voli ja põrkavad üksteisega; nende käitumist kirjeldab ideeliselt gaaside kineetiline teooria.
- Vedelikes on molekulid küll sidemete ja intermolekulaarsete jõudude poolt piiratumad, kuid saavad ümber paigutuda ja voolata.
- Tahkistes on orgaanilised molekulaarsed ained sageli paigutunud kristallvõresse, kus üksikud molekulid vibreerivad ümber oma tasakaalupunkti.
- Plasmas on osakesed ioniseeritud ja seetõttu ei moodustu tavapärased molekulid.
Molekulide kirjeldamine ja arvutused
Molekuli kirjeldamiseks kasutatakse mitut vormi:
- Molekulaarvalem — näitab iga elemendi aatomite arvu molekulis (nt H2O, CO2, C6H12O6).
- Empiiriline valem — lihtsaim täisarvuline suhe elementide vahel (nt glükoosi empiiriline valem on CH2O).
- Struktuurvalem — näitab, kuidas aatomid on omavahel seotud (sidemed ja järjestus); struktuurvalem võib olla kahe- või kolmemõõtmeline.
- Molekulmass (molekulaarmass) — summaarne mass kõigist aatomitest molekulis, tavapäraselt g·mol−1 (moolimass).
Erandid ja täpsustused
Mõned ained ei esine eristatud molekulidena. Näiteks ioonkristallid (nt NaCl) ja võrgukondsed tahked ained (nt süsiniku allotroop diamant või ränidioksiid SiO2) koosnevad suurest võrgust, kus ükski kindel „molekul” ei eksisteeri eraldi. Samuti võivad elemendid moodustada diatomilisi molekule (O2, N2, H2) või suuremaid molekulaarseid komplekse ja biomolekule (valgud, polümeerid), mille puhul mõiste „molekul” laieneb.
Näited
- H2 — vesinikmolekul (diatomiline, gaas).
- O2 — hapnikumolekul (diatomiline, gaas).
- CO2 — süsinikdioksiid (lineaarne molekul, gaas), oluline kasvuhoonegaas.
- H2O — vee molekul (kumer, tugeva vesiniksildumisega), oluline eluks ja lahustipõhiseks keemiaks.
- CH4 — metaan (tetraeedriline, lihtne orgaaniline molekul, peamine maagaasi komponent).
- C6H12O6 — glükoos (orgaaniline monosahhariid, toitumise ja ainevahetuse seisukohalt oluline).
Kokkuvõtlikult: molekul on aatomite kooslus, millel on määratletud struktuur ja omadused. Mõistmine, kuidas aatomid molekulis paigutuvad ja millised sidemed neid hoiavad, on aluseks nii keemia, füüsika kui ka bioloogia paljudele nähtustele.
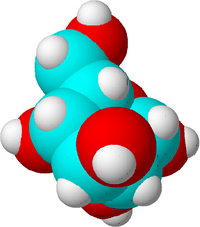
See on suhkrumolekul. Süsiniku aatomid on tehtud siniseks, hapniku aatomid punaseks ja vesiniku aatomid valgeks, et näidata erinevust. Tegelikkuses ei ole aatomitel värvi.
Bonding
Molekuli eksisteerimiseks peavad aatomid kokku kleepuma. See juhtub siis, kui kaks aatomit jagavad elektrone. Selle asemel, et ringelda ainult ühe aatomi ümber, ringleb elektron nüüd kahe aatomi ümber. Seda nimetatakse kovalentseks sidemeks. Mõnikord jagatakse rohkem kui üks elektron. Mida rohkem elektrone jagatakse, seda tugevamaks muutub side ja seda tugevamini aatomid koos püsivad.
Sidemeid saab ka lõhkuda. Kuna enamik sidemeid nõuab moodustumiseks energiat, annavad nad ka energiat, kui nad purunevad. Kuid enne, kui enamik sidemeid puruneb, tuleb molekuli kuumutada. Siis hakkavad aatomid liikuma ja kui nad liiguvad liiga palju, siis side puruneb. Molekule, mille purunemiseks on vaja vähem energiat, kui nad purunemisel loovad, nimetatakse kütusteks. Näiteks küünal lihtsalt istub ja midagi ei juhtu. Kui aga süütad selle tiku abil, põleb see kaua aega. Tikk toob energiat esimeste sidemete lõhkumiseks, mis vabastab piisavalt energiat, et lõhkuda allapoole jäävaid sidemeid, kuni küünal on maha põlenud.
On olemas ka ioonsed sidemed.
Küsimused ja vastused
K: Mis on molekul?
V: Molekul on keemilise aine väikseim kogus, mis võib eksisteerida. See koosneb aatomitest, mis on kokku kleebitud teatud kujul või vormis.
K: Mitu sidet on hapniku, süsiniku ja lämmastiku aatomitel?
V: Hapniku aatomitel on alati kaks sidet teiste aatomitega, süsiniku aatomitel on alati neli sidet teiste aatomitega ja lämmastiku aatomitel on alati kolm sidet teiste aatomitega.
K: Mida väidab gaaside kineetiline teooria molekulide kohta?
V: Vastavalt gaaside kineetilisele teooriale kasutatakse sageli mõistet molekul iga gaasilise osakese kohta, sõltumata selle koostisest. See tähendab, et väärisgaasi aatomeid peetakse molekulideks, kuna nad on tegelikult üheaatomilised molekulid.
K: Kuidas käituvad molekulid erinevates olekutes?
V: Gaasides, nagu õhk, lendavad molekulid lihtsalt ringi. Vedelikes, nagu vesi, on molekulid kokku kleepunud, kuid nad võivad siiski liikuda. Tahketes ainetes, nagu suhkur, saavad molekulid ainult vibreerida. Plasmas (aine neljas olek) on aatomid ioniseeritud ja ei saa moodustada molekule.
K: Mis on molekulaarvalem?
V: Molekulaarvalemi abil kirjutatakse üles kõigi molekuli aatomite arvud. Näiteks C6H12O6 tähistab ühte glükoosimolekuli, mis koosneb kuuest süsinikuaatomist, kaheteistkümnest vesinikuaatomist ja kuuest hapniku aatomist.
Otsige