Kovalentsed sidemed: määratlus, tekkemehhanism ja omadused
Kovalentsed sidemed: selge määratlus, tekkemehhanism ja omadused — kuidas valentselektronide jagamine moodustab molekule (nt vesi), sideme tugevus, polaarsus ja näited.
Kovalentsed sidemed on keemilised sidemed, mis tekivad kahe või enama mittemetalli aatomi vahel siis, kui aatomid jagavad ühist elektronipaari (või elektronipaare). Tüüpiline näide on vesi, kus vesinik (H) ja hapnik (O) seovad end kokku, moodustades ( H2O ). Kovalentse sideme tekkimise põhjuseks on soov saavutada stabiilsem elektronkonfiguratsioon: enamik aatomeid saavutab täieliku väliskesta (täielikul väliskoorel on tavaliselt kaheksa elektroni, vesiniku või heeliumi puhul kaks), jagades või üheskoos kasutades valentselektrone.
Tekkemehhanism lühidalt
Aatomi elektronide paigutust määrab tuuma positiivne laeng (aatomi prootonite arv) ja kvantmehaanilised orbiidid. Elektronide kestade struktuur ja orbiidid on määratud kvantmehaanikaga. Esimeses kihis võib olla kuni kaks elektroni, järgnevatel kihtidel tavaliselt kuni kaheksa. Valentselektronid asuvad väliskihis ja on seetõttu madalama sidumisenergiaga ehk „lõdvemalt” seotud kui sisemised elektronid.
Kovalentse sideme tekkides lähenevad kaks aatomit üksteisele nii, et nende väliskihis asuvad orbiidid hakkavad üksteisega kattuma. Orbiidide kattumisel tekib madalama energiaga siduv molekuliorbitaal, kuhu elektronid võivad paigutuda. Elektronide paari moodustumisel on oluline ka Pauli välistusprintsiip — moodustunud paar sisaldab kahte vastassuunalist spinniga elektroni. Sideme tekkimisel vabanev energia muudab süsteemi stabiilsemaks; sideme lõhkumiseks tuleb sama palju energiat juurde anda.
Orbitaalside ja sidemetüübid
- Sigmaside (σ) — tekib otsekohalise (axiaalse) orbitaalide kattumisel, on tavaliselt tugevam ja esineb üksiksidemete puhul ning ka üks osa topelt- ja kolmiksidemetest.
- Piiside (π) — tekivad külgse kattumise tulemusena p- või d-orbitalide vahel; esinevad topelt- ja kolmiksidemete puhul lisaks sigmasidemele ning on üldiselt nõrgemad kui σ-sidemed.
- Datiivne (koordinaat) kovalentne side — mõlemad sideme elektronid on pärit ühest aatomist (näiteks NH4+ moodustumisel).
Sidemete klassifikatsioon ja omadused
- Ühe-, topelt- ja kolmikside: üheks sidemeks on üks elektronipaar; topeltside sisaldab ühte σ- ja ühte π-sidet; kolmikside sisaldab ühte σ- ja kahte π-sidet. Rohkem elektronipaare → lühem ja tugevam side, aga ka reaktiivsem piissidemete tõttu.
- Polaarne vs mittpolaarne: kui kahe aatomi elektronegatiivsus on sarnane (näiteks H–H, C–H), on side mittpolaarne — elektronitihedus jaguneb võrdsemalt. Kui aga üks aatom on palju elektronegatiivsem (nt O vs H), nihkub elektronitihedus elektronegatiivsema aatomi poole, tekib osaline laeng (δ– elektronegatiivsemal, δ+ vähem elektronegatiivsel): see on polaarne kovalentside. Seetõttu on vee molekul polaarne: hapnik kannab osalist negatiivset laengut (δ–) ja vesinikud osalist positiivset laengut (δ+), mis selgitab vee dipoolset käitumist ja vesiniksidemete tekkimist.
- Sidemete tugevus ja pikkus: tüüpiliselt on topelt- ja kolmiksidemed lühemad ning tugevamad kui üksiksidemed. Sideme tugevust mõõdetakse sideme energia (kJ/mol) või lõhkumisenergia abil ning see sõltub orbitaalide kattumisest ja elementide olemusest.
Olulised lisamõisted
Elektronegatiivsus määrab, kui tugevalt aatom elektronipaari poole tõmbab. Paulingu skaala on sagedamini kasutatav elektronegatiivsuse mõõt. Kovalentse sideme polaarsus on otseselt seotud kahe siduva aatomi elektronegatiivsuse erinevusega.
Lewis’i struktuurid ja okteti reegel: kovalentsidemeid kirjeldatakse sageli Lewis’i punktstruktuuridega, kus elektronpaarid näidatakse punktidena või joontega. Okteti reegel (täida väliskihis kaheksa elektroni) on hea heuristika enamikule rühmakaasaegsetele elementidele, kuid on erandeid: alfa-elementide (nt Be, B) alakomplektid ja laiendatud oktett (nt P, S, mõned üleminekuained) dimeeruvad või moodustavad teistsuguse elektronjaotuse. Samuti on oluline resonants — olukord, kus tegelik elektronjaotus on mitme Lewis’i vormi hübriid.
Praktilised näited
- H2 — lihtsaim kovalentne side: kaks vesinikuaatomit jagavad ühte elektronipaari ja moodustavad σ-sideme.
- O2 — molekulis on topeltside (üks σ ja üks π) ning molekuli elektronstruktuur selgitab ka selle paramagnetilist käitumist.
- H2O — iga vesinik jagab ühe elektroni hapnikuga; hapnik on elektronegatiivsem ning kannab seetõttu osalist negatiivset laengut, vesinikud osalist positiivset laengut — molekul on dipoolne.
- CH4, CO2, NH3 — näited erinevast kovalentsete sidemete paigutusest ja molekulaarstruktuuridest (tetraeedriline, lineaarne, kolmnurkne lameda kujuga jm).
Olulised märkused ja järeldus
Kovalentsed sidemed on keemilistele ühenditele iseloomulikud ja määravad suure osa ainetes esinevatest füüsikalistest ja keemilistest omadustest: lahustuvus, sulamispunkt, keemiline reaktiivsus, molekulide geomeetria ja paljud muud omadused. Kovalentset sidet ei tasu segi ajada ioonilise sidemega, kus aatomid annavad ja võtavad elektrone täielikult, moodustades ioonid. Sageli leidub aineid, mille sidemed paiknevad kahe äärmusliku tüübi vahel (polaarne kovalentside vs iooniline karakter).
Üksikasjalikumaks arusaamiseks saab kasutada molekulorbitaleooriat ja kvantmehaanikat, mis kirjeldavad orbitaalide kombinatsioone, energiataset ja magnetilisi omadusi täpsemalt. Kovalentsed sidemed on keemia keskne teema, mis aitab selgitada nii lihtsaid molekule kui ka keerulisi biomolekule ja materjale.
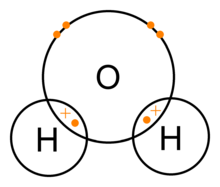
Vee (H2O) kovalentsed sidemed
Kovalentsete sidemete tüübid
Aatomiorbitaalid (välja arvatud s-orbitaalid) moodustavad eri tüüpi kovalentsed sidemed:
- Sigma (σ) sidemed on kõige tugevamad kovalentsed sidemed. Neil on kahe erineva aatomi orbitaalide otsene kattumine. Ühe sideme puhul on tavaliselt tegemist σ-sidemetega.
- Pi (π) sidemed on nõrgemad ja tulenevad p (või d) orbitaalide külgmisest kattumisest.
- Kahe antud aatomi vahelisel kaksiksidemel on üks σ- ja üks π-side ning
- kolmiksidemel on üks σ- ja kaks π-sidet.
Kovalentsed sidemed on nõrgemad kui ioonsed sidemed ja neil on madalam sulamistemperatuur. Samuti on nad üldiselt halvad elektri- ja soojusjuhid.
Sideme pikkus
Keemias on sideme pikkus kovalentsete sidemete suuruse mõõtühik. Kuna molekulid on väga väikesed, mõõdetakse neid pikomeetrites ehk umbes miljardikmillimeetris.
Molekulide keemiat seletatakse peamiselt nende sidemetega ja nende sidemete põhjuseks on nende elektronide struktuur.
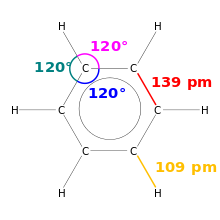
Benseeni joonistamine. Näidatud on sidemete pikkused ja sidemete nurgad.
Seotud leheküljed
- Valentsus
Küsimused ja vastused
K: Mis on kovalentne side?
V: Kovalentsed sidemed on keemiline side kahe mittemetalli aatomi vahel, kus aatomid jagavad valentselektroneid. See loob elektronorbitaali, mis on seotud mõlema aatomituuma külge ja millel on madalam energiatase kui algsel elektronorbitaalil. Selle tulemusena on elektroni andnud aatomil väike positiivne netolaeng ja teisel aatomil väike negatiivne netolaeng, mida hoiab koos elektromagnetiline tõmbejõud positiivsete ja negatiivsete laengute vahel.
Küsimus: Mitu elektroni on tavaliselt aatomi väliskoorel?
V: Aatomi väliskestas on tavaliselt kuni kaheksa elektroni, vesiniku või heeliumi puhul kaks.
K: Mis määrab aatomi elektronide arvu?
V: Aatomi elektronide arvu määrab aatomi prootonite arv.
K: Kuidas tekivad kovalentsed sidemed?
V: Kovalentsed sidemed tekivad, kui aatomid lähenevad üksteisele ja üks lõdvalt hoitud elektron ühest aatomist hüppab uuele orbitaalile, mis on seotud mõlema aatomituuma madalama energiatasemega kui varem. Selle tulemusel on ühel aatomil väike positiivne netolaeng ja teisel väike negatiivne netolaeng, mis tekitab nende vahel elektromagnetilise tõmbejõu.
Küsimus: Mis tüüpi molekul on vesi?
V: Vee molekulid koosnevad ühest hapniku aatomist ja kahest vesiniku aatomist, mida hoiavad koos kovalentsed sidemed, mistõttu on see polaarne molekul, sest selle laeng ei ole ühtlaselt jaotunud.
K: Kus tiirlevad elektronid ümber aatomituuma?
V: Elektronid tiirlevad ümber aatomituumade nagu udusad orbiidid.
Otsige