Pi-sidemed (π) — definitsioon, omadused ja keemiline tähendus
Pi-sidemed (π) — selge definitsioon, omadused ja keemiline tähendus: kuidas tekivad, miks nõrgemad kui σ-sidemed, roll molekulistruktuuris, reaktsioonis ja elektronide hajumises.
Pi-sidemed (π-sidemed) on keemias kovalentsed keemilised sidemed, mis tekivad siis, kui kahe aatomi elektroni p-orbitaalide lobid kattuvad paralleelselt teineteisega. Sellises kattumisalas on tavaliselt kaks eraldiseisvat kattuvat piirkonda (üks kummalgi pool tuumade vahelist telge), mistõttu räägitaksegi π-sidetest kui kahe-ala kattumistest. Elektroni tõenäosusjaotus p-orbitaalides ei ole sfääriline, vaid lobilaadne (vt. joonis), mistõttu on π-sideme kattumine tavaliselt väiksem kui vastaval σ-sidemel.
Struktuur ja sümmeetria
Kreeka täht π nende sidemete nimes viitab p-orbitaalidele: π-sideme molekulaarorbitaalide sümmeetria näeb sideme teljest vaadatuna välja nagu p-orbitaalide paar. P-orbitaalidel on kaks lobpi, mistõttu kattuvad mõlema orbitaali vastavad lobid ja tekib kaks kattuvat piirkonda. Pi-sideme korral läbib ainult üks orbitaalide sõlmpunktide tasanditest mõlema osaleva aatomi tuuma, erinevalt sigma-sidemest, mille korral on maksimaalne elektronitihedus tavaliselt tuumade vahetel.
Lisaks p-orbitaalidele võivad π-tüüpi sidemed tekkida ka d-orbitaalide vahel (näiteks mõnedes üleminekmetalli komplekssides), kuid selle korral on sideme omadused ja kattumine keerukamad ning sageli nõuavad täpsemat kvantmehaanilist kirjeldust. Selline d-orbitaalide kaasatus on seotud ka hüpervalentsuse ja laiema orbitaalide hübriidiga.
Pi- vs sigma-sidemed
Pi-sidemed on tavaliselt nõrgemad kui sigma sidemed. Selle põhjuseks on kvantmehaaniline efekt: orbitaalide kattumine on pi-sidemete puhul väiksem, sest p-orbitaalide lobid on paigutunud paralleelselt, mitte otse tuumade vahele suunatult. Seega on π-sidemed energialt kõrgemad ja kergemini katkestatavad kui σ-sidemed.
Oluline keemiline erinevus on ka vabadus pöörlemiseks: molekulaarfragmendid, mis on seotud π-sidemega, ei saa seda sidet ümber vaba telje pöörata ilma π-sidet lõhkumata. Pöörlemine hävitaks p-orbitaalide paralleelse orientatsiooni ja seega π-kattumise, mis seletab näiteks topoloogilisi erinevusi trans- ja cis-isomeeride vahel alkeenides.
Moolekulaarsed orbitaalid ja elektronide omadused
Kui p-orbitaalid kattuvad konstruktiivselt, tekib siduv π-molekulaarorbitaal. Kui kattumine toimub destruktiivselt, tekib antisdidev π* (π-tärn) orbitaal — see on kõrgema energiaga ja selles paiknevad elektronid nõrgendavad sidet. Pi-elektrone nimetatakse sageli π-elektronideks. Mitme järjestikuse π-sideme olemasolul võib tekkida π-süsteemi delokaliseerumine, kus elektronid ei kuulu kindlalt kahe konkreetse aatomi vahele, vaid on hajutatud üle mitme aatomi (nt konjugeeritud dioleenides ja aromaatsetes süsteemides).
Keemiline tähendus ja reaktsiooniomadused
Pi-sidemed määravad paljusid orgaanilise keemia reaktsioone ja omadusi:
- Topel- ja kolmsidemetes koosnevad sidemed tavaliselt ühest σ- ja ühest või kahest π-sidemest; näiteks süsiniku‑süsiniku kaksiksidemes on üks σ- ja üks π-side, mis annab sideme tugevuse ja lühendatud pikkuse võrreldes üksiksidemega.
- Konjugeeritud π-süsteemid stabiliseerivad molekule läbi delokaliseerumise, võimaldades resonantsi ja madalamat koguenergiat (näiteks butaen, dienid).
- Aromaatsed süsteemid (nt benseen) on eriti stabiilsed pikaajalise π-delokaliseerumise tõttu ja nende reaktsioonid (nt elektroonivahetused) erinevad lihtsatest alkeenidest: aromaatseid rõngasid hakatakse eelistatult asendama, mitte lisama.
- π-elektronid on sageli reaktiivsed elektrooniliste rünnakute suhtes: alkeenid osalevad elektrooniliselt lisamisreaktsioonides (elektrofiilne additions), aromaatsed süsteemid aga elektrooniliselt substiituvad (elektrofiilne asendamine).
- Pi-süsteemid mõjutavad lämmastiku- ja hapniku aatomite happe‑leelisust ning regio‑ ja stereoselektiivsust orgaanilistes reaktsioonides (nt allyl- või benzüülsed positsioonid on reaktiivsemad).
Spektroskoopia ja elektroonilised üleminekud
π→π* ja n→π* (mittesiduvad elektroni kuni π* tasemele) üleminekud on olulised UV‑Vis spektroskoopia interpretatsioonis. Konjugeeritud süsteemide puhul langeb π→π* ülemineku energia, mistõttu need absorbeerivad pikema lainepikkusega valgust ja võivad olla värvilised (näiteks karotenoidid).
Kokkuvõte ja praktilised näited
Pi-sidemed on fundamentaalsed keemilised sidemed, mis tekivad p-orbitaalide paralleelsest kattumisest. Nad on tavaliselt nõrgemad kui σ-sidemed, piiravad rotatsiooni molekuli sees ja võimaldavad elektronide delokaliseerumist üle mitme aatomi. Pi-sidemed määravad paljusid orgaanilise molekulide füüsikalisi omadusi ja keemilisi reaktsiooniteid — alates alkeenide lisamisest kuni aromaatsuse ja värvuse tekkimiseni. Klassikalised näited on C=C kaksiksidemed, benseeni aromaatne rõngas ja konjugeeritud dioleenid.
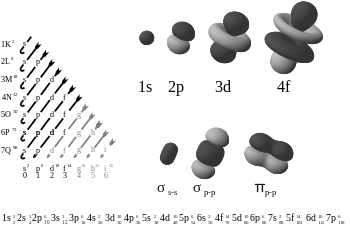
Aatomi ja molekuli elektronorbitaalid, mille paremal allosas on kujutatud pi-side.

Kaks p-orbitaali moodustavad π-sideme.
Mitu sidet
Aatomitel, mis on ühendatud kaksiksidemega, on üks sigma- ja üks pi-side. Kui nad on ühendatud kolmiksidemega, on neil üks sigma- ja kaks pi-sidet.
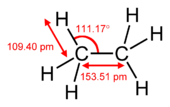
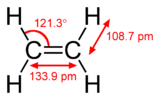
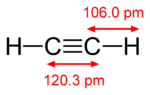
Pii-side on nõrgem kui sigma-side, kuid pi- ja sigma-side kombinatsioon on tugevam kui kumbki side eraldi. Mitmekordse sideme lisatugevus võrreldes ühekordse (sigma sidemega) on näidatud mitmel viisil. Kõige ilmsem on sideme pikkuse vähenemine. Näiteks orgaanilises keemias on süsinik-süsinik sidemete pikkused etaanis (154 pm), etüleenis (134 pm) ja atsetüleenis (120 pm). Rohkem sidemeid muudab kogu sideme lühemaks ja tugevamaks. Elektrooniline konfiguratsioon põhineb S,P,D,ja f -blokil. S-l on 2 elektroni P-l on 6 elektroni D-l on 10 elektroni F-l on 14 elektroni.
|
|
|
|
| etaan | atsetüleen |
Erijuhtumid
Pi-sidemed ei ühenda tingimata paari aatomeid, mis on samuti sigmasidemed.
Teatud metallikompleksides moodustavad metalli aatomi ja alküüni ja alkeeni pi-antisideme orbitaalide vahelised pi-sidemed.
Mõnel juhul, kui kahe aatomi vahel on mitu sidet, ei ole üldse sigma sidet, vaid ainult pi sidemed. Näidetena võib tuua diraatheksa-karboonüüli (Fe2(CO) 6), dikarbonüüli (C 2) ja booraani B 2H 2. Nendes ühendites on keskne side ainult pi-sidemetega. Selleks, et saavutada võimalikult suur orbitaalide kattuvus, on sidemete vahemaad oodatust palju lühemad.
Küsimused ja vastused
K: Mis on keemias pi-ühendus?
V: Pi-side on kovalentne keemiline side, kus ühe elektroni orbitaalirada ristub teise elektroni orbitaaliga, tekitades kaks kattumisala, kuna radad kattuvad mõlemal lobil.
K: Millisele kreeka kirjale viitab nende nimi?
V: Kreeka täht, millele nende nimes viidatakse, on π ja see viitab p-orbitaalidele.
K: Milline on pi-sidemete orbitaalide sümmeetria?
V: Pi sideme orbitaalsümmeetria näeb sidemeteljel vaadatuna välja nagu p orbitaal, sest p orbitaalidel on tavaliselt selline sidemete paigutus.
K: Miks on pi-sidemed tavaliselt nõrgemad kui sigma-sidemed?
V: Pi sidemed on tavaliselt nõrgemad kui sigma sidemed, sest kvantmehaanika kohaselt on orbitaalide teekonnad paralleelsed, seega on p-orbitaalide kattuvus palju väiksem.
K: Millal tekivad pi-sidemed?
V: Pi-sidemed tekivad siis, kui kaks aatomi orbitaali puutuvad kokku kahe kattumisala kaudu.
K: Mis on pi-sidemed?
V: Pi-sidemed on hajutatumad sidemed kui sigma-sidemed.
K: Kas pi-sidemega ühendatud molekulaarfragmendid võivad selle sideme ümber pöörelda, ilma et pi-side puruneks?
V: Ei, pi-sidemega ühendatud molekulaarfragmendid ei saa selle sideme ümber pöörelda ilma pi-sidet lõhkumata, sest pöörlemine hävitab kahe p-orbitaali paralleelsed teed.
Otsige