Vesiniku isotoobid: protium, deuteerium ja triitium selgitatud
Vesiniku isotoobid selgitatud: protium, deuteerium ja radioaktiivne triitium — omadused, erinevused ja rakendused lihtsas ja ülevaatlikus kokkuvõttes.
Vesinikul on kolm peamist isotoopi: protium (1H), deuteerium (2H) ja triitium (3H). Need isotoobid esinevad looduses erinevas hulgas. Protium on kõige levinum, deuteerium on stabiilne aga haruldasem ning triitium on radioaktiivne ning selle poolväärtusaeg on ligikaudu 12,3 aastat. Lisaks on laboris toodetud veel raskemaid vesiniku isotoope (näiteks 4H kuni 7H), kuid need on väga ebastabiilsed ja ei esine looduses.
Peamised omadused lühidalt
- Protium (1H): koosneb ühest prootonist ja ei sisalda neutronit. See moodustab suurema osa looduses leiduvast vesinikust ja on keemiliselt aktiivne elementaarne vesinik.
- Deuteerium (2H, D): koosneb ühest prootonist ja ühest neutronist. Massiliselt on deuteerium ligikaudu kaks korda raskem kui protium. Looduslik kontsentratsioon on umbes 0,015–0,02% (u 150–200 ppm). Deuteerium on stabiilne.
- Triitium (3H, T): koosneb ühest prootonist ja kahest neutronist. Triitium on radioaktiivne beeta-emitent ja tekib väikestes kogustes kosmilise kiirguse mõjul või inimtekkelistes protsessides (reaktorid, tuumakatsetused). Selle poolväärtusaeg on umbes 12,3 aastat.
Kasutusalad ja tähtsus
- Protium on tavalise vee ja orgaaniliste ühendite vesiniku vorm ning osaleb kõikides tavapärastes keemilistes reaktsioonides, sealhulgas kütuste (nn vesinikkütus) ja hüdride moodustumisel.
- Deuteerium on oluline teaduslikus ja tööstuslikus kasutuses: deuteeritud vesi (D2O ehk "raske vesi") on neutronite aeglustajana tuumareaktorites, deuteeriumit kasutatakse ka isotopiliseks märgistamiseks orgaanilistes ja bioloogilistes uuringutes ning tuumaspektroskoopias (NMR) eristamiseks protiumist.
- Triitium leiab kasutust tuumaütlemistes (D–T kütus fuusioonikatsetes), radiomärgistajana jälgimisuuringutes ja isesäravate märgistustahvlite/toodete valgustusallikana. Kuna triitium on radioaktiivne, nõuab selle kasutamine ja käitlemine eriluba ja ettevaatusabinõusid.
Tootmine ja levik
Deuteerium tekib peamiselt moodustudes varasema kosmilise protsessi tulemusel ja on looduses stabiilselt olemas merevees. Triitium tekib nii kosmilise kiirguse tagajärjel atmosfääris kui ka tuumareaktsioonide käigus; inimtekkelist triitiumi on tekkinud näiteks tuumakatsetuste ja mõningate reaktoriprotsesside tagajärjel. Tööstuslikult saadakse deuteeriumi ja triitiumi eri meetoditega (distillatsioon, elektrolüüs, neutronikokkupõrgetest tekkiv süntees jms).
Nimede ja sümbolite kasutamine
Vesiniku peamised isotoobid on ainulaadsed selle poolest, et neil on oma nimed. Deuteerium ja triitium tähistatakse sageli lühenditega D ja T, kuid Rahvusvahelisele Puhta ja Rakenduskeemia Liidule (IUPAC) eelistatakse ametlikult tuvastada isotoope numbrilise sümbooliga (näiteks 2H ja 3H). Kuigi D ja T on igapäevases kasutuses mugavad, eelistavad teaduslikud publikatsioonid ja ametlik terminoloogia sageli just numbrilisi kujutisi.
Muud vesiniku isotoobid
Lisaks kolmele peamisele isotoobile on tuvastatud ka raskemad ja üli-raskeid vesiniku isotüüpe (4H kuni 7H). Need tekivad laboritingimustes tuumareaktsioonides ja on äärmiselt ebastabiilsed – nende eluiga on väga lühike (väga väikesed murdosa sekundist), mistõttu neil pole praktilist rolli igapäevases keskkonnas.
Ohutus
Deuteerium ise ei ole radioaktiivne ja ei kujuta erilist radioloogilist ohtu; see on kemikaalina ohutu vastavalt kasutustingimustele. Triitium on madala energia beeta-kiirguse allikas: välist kiirgust on vähe, kuid triitiuminainega segunenud vesi (HTO) võib keha sisse sattudes kujutada sisseimendumisel sisemist radioloogilist ohtu. Sellepärast reguleeritakse triitiumi käitlemist ja käimasolevaid emissioone rangelt.
Kokkuvõtlikult on protium, deuteerium ja triitium vesiniku kolm põhilist isotoopi, mis erinevad neutronite arvus, massis, stabiilsuses ja kasutusalades — alates tavakeemiast kuni tuumatehnoloogia ja teaduslike uuringuteni.
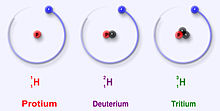
Kolm kõige stabiilsemat vesiniku isotoopi
Protium (vesinik-1)
Protium on vesiniku kõige levinum isotoop. See moodustab üle 99,98% kogu universumi vesinikust. Seda nimetatakse protiumiks, sest selle tuumas on ainult üks prooton. Protiumi aatommass on 1,00782504(7) u. Protiumi sümbol on 1H.Protiumi prooton ei ole vaatluse käigus kunagi lagunenud, mistõttu teadlased usuvad, et protium on stabiilne isotoop. Uued osakestefüüsika teooriad ennustavad, et prooton võib laguneda, kuid see lagunemine on väga aeglane. Protoni poolestusaeg on väidetavalt 1036 aastat. Kui prootoni lagunemine vastab tõele, siis kõik teised tuumad, mida peetakse stabiilseks, on tegelikult ainult vaatluslikult stabiilsed, st nad näivad olevat stabiilsed. Hiljutised katsed on näidanud, et kui prootoni lagunemine tõepoolest toimub, siis on selle poolväärtusaeg 6,6 × 1033 aastat.
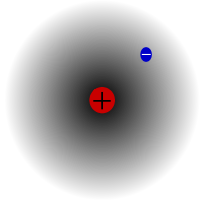
Protium, vesiniku kõige levinum isotoop. See on eriline, sest see on ainus isotoop, millel puudub neutron.
Deuteerium (vesinik-2)
Deuteerium ehk 2H või mõnikord D on teine vesiniku stabiilne isotoop. Sellel isotoobil on üks prooton ja üks neutron. See moodustab umbes 0,0026-0,0184% kõigist Maa vesinikuaatomitest. Deuteeriumi on Maa vesinikgaasis vähem ja merevees rohkem (0,015% ehk 150 ppm). Deuteerium ei ole radioaktiivne ja see ei kahjusta elusolendeid. Deuteerium võib moodustada ka veemolekule. Vett, milles on protiumi asemel deuteeriumi, nimetatakse raskeks veeks.
Triitium (vesinik-3)
Triitium (3H) on vesiniku kõige stabiilsem radioisotoop. See tähendab, et vesiniku radioaktiivsetest isotoopidest on triitium kõige vähem radioaktiivne. Selle tuumas on üks prooton ja 2 neutronit. Triitium laguneb beetamiinuse lagunemise teel ja muutub heelium-3-ks. Selle poolväärtusaeg on 12,32 aastat.Triitium tekib looduslikult ülemise atmosfääri gaaside ja kosmilise kiirguse koostoimel. Seda tekib ka tuumarelvakatsetuste käigus. Triitiumi ja deuteeriumi kasutatakse tähtede D-T tuumasünteesi puhul, et anda välja palju energiat.
Küsimused ja vastused
K: Mitu peamist vesiniku isotoopi on olemas?
V: Vesiniku põhilisi isotoope on kolm: protium, deuteerium ja triitium.
K: Kas protium ja deuteerium on stabiilsed isotoobid?
V: Jah, protium ja deuteerium on stabiilsed isotoobid.
K: Milline on triitiumi poolväärtusaeg?
V: Triitium on radioaktiivne ja selle poolväärtusaeg on umbes 12 aastat.
K: Mitu muud vesiniku isotoopi on teadlased loonud?
V: Teadlased on loonud veel neli vesiniku isotoopi: 4H kuni 7H.
K: Kas need neli täiendavat vesiniku isotoopi eksisteerivad looduses?
V: Ei, need isotoobid on väga ebastabiilsed ja neid ei ole looduslikult olemas.
K: Mis teeb vesiniku põhilised isotoobid ainulaadseks?
V: Vesiniku peamised isotoobid on ainulaadsed, sest need on ainsad isotoobid, millel on nimi.
K: Kas deuteeriumil ja triitiumil on oma sümbolid?
V: Jah, deuteerium ja triitium saavad mõnikord oma sümbolid: D ja T. Rahvusvahelisele Puhta ja Rakenduskeemia Liidule ei meeldi need nimed siiski väga, kuigi neid kasutatakse sageli.
Otsige