Üksikpaar (elektronipaar) — määratlus, omadused ja roll keemias
Üksikpaar (elektronipaar) — määratlus, omadused ja roll keemias: valentsielektronid, nukleofiilsus, molekuli kuju ja sidemete moodustumine.
Üksikpaar on kahest elektronist koosnev rühm, mida ei kasutata üheski aatomitevahelises sidemes. Nad asuvad alati aatomi viimases kestas, valentsikoores, ja koos sidemetes kasutatavate elektronidega moodustavad nad valentselektronide koguarvu. Üldiselt on nende energia tavaliselt kõrgem kui siduselektronitel ja nad on lokaalselt seotud ühe aatomiga.
Omadused ja kirjeldus
Üksikpaarid (inglise keeles "lone pairs" või "nonbonding pairs") on elektronid, mida ei jagata kahe aatomi vahel. Neid tähistatakse keemiliste kirjutiste juures sageli punktidena (Lewis'i punktid) aatomi ümber. Mõned olulised omadused:
- Asukoht: paiknevad valentsikoores ja on lokaalselt seotud konkreetse aatomiga.
- Energiateisus: tavaliselt kõrgema energiaga kui siduselektronid, sest neid ei stabiliseeri sidestamine kahe aatomi vahel.
- Hübriidiseerumine: üksikpaarid võivad paikneda erinevates hübriidorbitallides (nt sp3, sp2), mis mõjutab molekuli geomeetriat ja reaktiivsust.
- Formaalne laeng: ühe aatomi juures olevad üksikud paarid mõjutavad aatomi formaalset laengut ja seega ka molekuli üldist elektronjaotust.
Roll keemias ja reaktsioonivõime
Üksikpaarid mängivad mitmesuguseid tähtsaid rolle keemias:
- Nukleofiilsus ja aluselisus: nukleofiilidel on sageli üksikud paarid, mida kasutatakse elektrofiili ründamiseks — nad annavad elektronipaari ja moodustavad uue sideme. Üksikpaaride olemasolu ja paiknemine mõjutavad aatomi põhiolekut (basicity) ja nukleofiilsust.
- Koordinatsioon ja komplekseerumine: lone-pairi kaudu saavad aatomid (nt lämmastik või hapnik) siduda metallioonidega, moodustades koordineeruvaid (donor-akseptor) sidemeid.
- Hüdrogeenisidumine: üksikpaarid (eriti hapnikul ja lämmastikul) võivad osaleda vesiniksidemete aktsepteerijatena, mis mõjutab lahuste omadusi ja bioloogilist struktuuri (nt vee omadused, valgustruktuurid).
- Resonants ja delokalisatsioon: mõnel juhul võib üksikpaar osaleda delokalisatsioonis pi-süsteemides (nt karboksüülhappe tärklis), mis muudab aatomi happelisust ja keemilist käitumist — amidi lämmastiku üksikpaar on osaliselt delokaliseeritud, vähendades selle põhiolekut.
Mõju molekuli kujule (VSEPR)
VSEPR-teooria järgi (elektronpaaride vastastikune tõrjumine) võtavad üksikpaarid aatomi ümber rohkem ruumi kui siduselektronid, sest nonbonding elektronid on rohkem lokaliseeritud ühe aatomi lähedal ja seetõttu suurema tõrjevõimega. Selle tagajärjel muutuvad sidemete vahelised nurgad:
- Näiteks vesi (H2O) — hapnikul on kaks üksikpaari ja kaks O–H sidet; vesi on V-kujuline ja H–O–H nurgaks ~104,5° (madalam kui tetraeedriline 109,5°).
- Ammoniaak (NH3) — üks üksikpaar ja kolm N–H sidet; H–N–H nurgaks ~107°.
Kirjeldamine ja loendamine Lewis'i struktuurides
Lewis'i struktuurides märgitakse üksikpaare punkti- või joontena aatomi ümber. Valentsielektronide loendamisel arvestatakse kõik üksikpaarid ning siduselektronid, et määrata formaalne laeng ja olla kindel okteti või muude stabiilsete paigutuste olemasolus. Lihtne viis määramiseks:
- Arvuta aatomi valentsielektronid.
- Jaga siduselektronid kaheks (iga sideme puhul) ja lisa järelejäänud elektronid kui üksikpaarid sellele aatomile.
Praktilised näited
- Hapnik veemolekulis: kaks üksikpaari — mõjutavad molekuli geomeetriat ja vesiniksidumise võimet.
- Lämmastik ammoniaagis: üks üksikpaar — toimib donorina metallkompleksides ja nukleofiilina orgaanilistes reaktsioonides.
- Kloori- või halogeniidiooni (Cl−) puhul: mitu üksikpaari — annavad ioonile negatiivse laengu ja võimaldavad osaleda hüdrogeen sidemetes ja nukleofiilsetes rünnakutes.
- Karbonüülühendites: ühe hapniku üksikpaar võib olla delocaliseeritud osana pi-süsteemist, mõjutades reaktsioonide regio- ja stereokeemiat.
Kokkuvõte
Üksikpaarid on valentsikoores paiknevad kahe elektroni komplektid, mis ei osale otseselt kisimeistri sidemetes, kuid mõjutavad tugevalt molekulide geomeetriat, reaktiivsust ja elektronjaotust. Nad on oluline mõiste nii lihtsates molekulides (vesi, ammoniaak) kui ka keerukates orgaanilistes ja koordinatsioonkeemilistes süsteemides — osaledes nukleofiilses rünnakus, koordineerumises metallidega, vesiniksidemetes ja resonantdelokalisatsioonis.
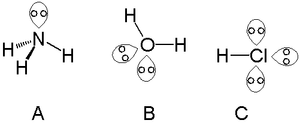
Üksikud paarid ammoniaagis (A), vees (B) ja soolhappes (C)
Otsige