Elektrofiil (keemia): määratlus, omadused ja näited
Elektrofiil (keemia): määratlus, omadused ja praktilised näited — mõistke elektrofiilide reaktiivsust ning nende rolli liitumis- ja oksüdatsioonireaktsioonides.
Keemias on elektrofiil molekul või aatom, mis aktsepteerib elektronpaari teiselt osakeseilt. Seda võib kirjeldada kui elektronikülluselt vaest piirkonda või elektronide vastuvõtjat; sageli omab elektrofiil positiivset või osaliselt positiivset laengut. Selliseid aineid nimetatakse ka Lewis'i hapeteks, sest nad aktsepteerivad elektronipaari Lewis'i aluse käest. Elektrofiilsuse põhjuseks võivad olla suur erinevus elektronegatiivsuse osakeste vahel (näiteks HCl) või funktsionaalrühmad, mis jätavad konkreetse aatomi osaliselt positiivseks (näiteks karbonüül-rühm). Samuti võivad elektrofiilidena käituda tugevad oksüdeerivad ained ja ioonid.
Elektrofiile ründab nukleofiil, mis on elektroniderikas liigendus või rühm. Selline vastastikmõju on tavapärane liitumisreaktsioonides, aga leiab aset ka asendus- ja eliminatsioonireaktsioonides. Näited tüüpreaktsioonidest:
- nukleofiilne lisandumine alkeenide või karbonüülide juurde;
- elektrofiilne aromaatne asend (EAS) benseeniringi funktsioneerimisel;
- SN1- ja SN2-tüüpi nukleofiilsed asendused, kus elektrofiilse keskme käitumine määrab mehhanismi.
Tüüpilised elektrofiilid ja nende omadused:
- karbokatioonid (R+): tugevad elektrofiilid, sageli reaktsioonide aktiivsed keskused;
- prootonid (H+): lihtsaim elektrofiil, mis aktiveerib paljusid orgaanilisi funktsioone;
- halogeniidi osakesed või halogeeni kationid (nt Br+, Cl+): kasutusel elektrofiiilsetes lisandites;
- alüül- ja atsiiliumioonid, nitrooniumioon (NO2+): spetsiifilised elektrofiiilid aromaatsete asenduste ja akülatsioonide jaoks;
- metallikompleksid ja haprad oksüdeerijad: võivad käituda elektrofiilidena organometallilistes ja redoks-reaktsioonides.
Elektrofiilsust mõjutavad tegurid:
- laeng: positiivne laeng suurendab elektrofilsust;
- elektronegatiivsuse erinevused ja indutseeriv mõju: elektronegatiivsed rühmad muudavad lähedalasuva aatomi osaliselt positiivseks;
- resonants ja delokaliseerimine: delokaliseeritud laeng vähendab sageli elektrofiilsust;
- stereokeemia ja steriline takistus: suured rühmad võivad takistada nukleofiili ligipääsu;
- lahusti ja temperatuuri efektid: polaarsed lahustid stabiliseerivad laenguid ja mõjutavad reaktsioonikiirusi;
- molekulaarorbitaalide kättesaadavus (LUMO): madalama energia LUMO teeb osakese reaktiivsemaks elektrofiilina.
Elektrofiilsust saab kvantitatiivselt kirjeldada ka elektrofiilsuse indeksiga (Parr'i ω) või hinnata reaktsioonikiiruste ja Hammetti konstantide kaudu. Praktilises keemias kasutatakse elektrofiilide mõistmist sünteetilistes strateegiates (nt funktsionaalsete rühmade lisamine, katalüüs, polümerisatsioon) ning reaktsioonitingimuste kujundamisel: elektrofiilsust saab suurendada näiteks kationi tekitamise, elektronide eemaldamise või tugeva Lewis'i happe lisamisega.
Lühikokkuvõte: elektrofiil on elektronide vastuvõtja (Lewis'i hape), kelle reaktsioone juhib positiivne või osaliselt positiivne laeng, orbitaalide ja struktuuri omadused. Elektrofiilne käitumine on keskne paljudes orgaanilistes ja anorgaanilistes reaktsioonides ning selle mõistmine aitab ennustada ja kavandada keemilisi transformatsioone.
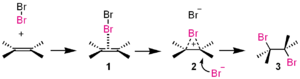
Selles liitumisreaktsioonis on broom (Br2 ) elektrofiiliks.
Küsimused ja vastused
K: Mis on elektrofiil?
V: Elektrofiil on molekul või aatom, mis võtab hea meelega elektronid teiselt molekulile või aatomile.
K: Miks nimetatakse elektrofiile ka Lewis'i hapeteks?
V: Elektrofiile nimetatakse ka Lewis'i hapeteks, sest nad suudavad teistelt molekulidelt elektronpaare vastu võtta.
K: Millised on mõned näited elektrofiilidest?
V: Mõned näited elektrofiilidest on molekulid, mille aatomitel on suur erinevus elektronegatiivsuses, nagu HCl või karbonüül, või ka oksüdeerivad ained.
K: Kuidas reageerivad nukleofiilid elektrofiilidega?
V: Nukleofiilid reageerivad elektrofiilidega, rünnates neid.
K: Mis on nukleofiil?
V: Nukleofiil on elektrofiilile vastupidine molekul. See on molekul või aatom, mis loovutab hea meelega elektrone.
K: Kuidas toimuvad liitumisreaktsioonid elektrofiilide ja nukleofiilide vahel?
V: Elektrofiilide ja nukleofiilide vahel toimuvad aditiivsed reaktsioonid, kui nukleofiil ründab elektrofiili, moodustades uue sideme.
K: Kas elektrofiilil võib olla negatiivne laeng?
V: Elektrofiilil võib olla positiivne laeng, kuid tal võib olla ka osaline positiivne laeng või laeng puudub üldse. Peamine omadus on see, et ta on valmis vastu võtma elektrone.
Otsige