Nukleofiil: definitsioon, omadused ja reaktsioonid
Nukleofiil: selge definitsioon, omadused ja reaktsioonid — mehhanismid, võrdlused ja praktilised näited õpilastele ja keemikutel.
Nukleofiil on liik, mis loovutab elektronpaari elektrofiilile, et moodustada reaktsioonis keemiline side. Kõik molekulid või ioonid, millel on vaba elektronpaar, võivad olla nukleofiilid. Seda elektronipaari nimetatakse üksikpaariks. Kuna nukleofiilid loovutavad elektrone, vastavad nad Lewis'i aluste määratlusele.
Nukleofiilsus kirjeldab nukleofiili tõmbumist tuumale. Nukleofiilsus, mida mõnikord nimetatakse nukleofiili tugevuseks, viitab aine nukleofiilsele iseloomule ja seda kasutatakse sageli aatomite atraktiivsuse võrdlemiseks.
Neutraalseid nukleofiilseid reaktsioone lahustitega, näiteks alkoholide ja veega, nimetatakse "solvolüüsiks". Nukleofiilid võivad osaleda nukleofiilsetes asendusreaktsioonides. Nukleofiil tõmbub nendes reaktsioonides täieliku või osalise positiivse laengu külge.
Peamised omadused ja eristused
Nukleofiilsus vs aluselisus: kuigi mõlemad seovad prootoneid või positiivseid keskusi, on olulisi erinevusi: aluselisus on termodünaamiline omadus ( kui tugevalt aine seob prootonit ), samas kui nukleofiilsus on enamasti kineetiline omadus ( kui kiiresti aine ründab elektrooniliselt defitsiitset süsinikku või muud keskpunkti ). Näiteks ioon I– on prototüüpselt tugev nukleofiil (eriti prootilises lahustis), kuid suhteliselt nõrk alus võrreldes F–-ga.
Mõjutavad tegurid
- Laeng: anioonid (nt OH–, RO–, CN–) on tavaliselt tugevamad nukleofiilid kui neutraalsed molekulid (nt H2O, RNH2), sest negatiivne laeng suurendab elektronide saadavust.
- Elektronegatiivsus: vähem elektronegatiivsed aatomid annavad oma elektronid kergemini — seega sama perioodi alguses olevad ained on sageli tugevamad nukleofiilid.
- Polarisatsioon: suuremad, rohkem polariseeruvad ioonid (nt Br–, I–) annavad elektronid „pehmemalt” ja on prototüüpselt head nukleofiilid, eriti prootilistes lahustites.
- Steriline takistus: suurte rühmadega nukleofiilid (hästitihendatud) ründavad raskemini, mis vähendab nende nukleofiilsust (nt t-BuO– on tugev alus, kuid kehvem nukleofiil kui MeO–).
- Resonants ja delokaliseerimine: elektronipaari delokaliseerimine (nt atseetaadi anioon) vähendab nukleofiilsust, sest „vaba” ühe koha elektronpaar pole nii koheselt saadaval rünnakuks.
- Lahusti mõju: oluline tegur. Polaarsetes prootilistes lahustites (nt alkoholid, vesi) solvateeruvad väiksemad tugevamad anioonid tugevalt, mis võib nende nukleofiilsust vähendada — seetõttu protolises keskkonnas nukleofiilsus sageli suureneb allagrupi suunas (F– < Cl– < Br– < I–). Polaarsetes aprootilistes lahustites (nt DMSO, DMF) solvateerumine on väiksem, ja nukleofiilsus kipub sarnanema baasilisuse järjestusega (F– on tugev nukleofiil).
Nukleofiilsete reaktsioonide tüübid
- Nukleofiilne asendamine (SN):
- SN2: bimolekulaarne mehhanism — reaktsiooni kiirus sõltub nii substraadist kui nukleofiilist; iseloomulik on päripoolne rünnak ja invertsioon süsiniku konfiguratsioonis. Tundlik sterikale ja tugevamatele nukleofiilidele.
- SN1: unimolekulaarne mehhanism — esmalt lahkub lahkumisrühm ja tekib karbokation; nukleofiili tugevus on siin vähem määrav, oluline on karbokatsiooni stabiilsus ja lahkumisrühma võime lahkuda.
- Nukleofiilne lisamine: nt karbonüülühenditele (aldehüüdid, ketoonid) — nukleofiil ründab süsinikku, moodustades tetraeedrilise vaheetapi (näiteks alkoholi sünteesid, tsüanoadditsioonid).
- Solvolüüs: veebüldis on solvolüüs protsess, kus lahusti (nt H2O või alkohol) toimib nukleofiilina ja osaleb reaktsioonis; sageli seotud SN1-protsessidega.
Praktilised näited ja tavalisemad nukleofiilid
- Tüüpilised anioonid: OH–, RO– (alkooxide), CN–, N3–, halogeniidid (Cl–, Br–, I–).
- Neutraalsed nukleofiilid: NH3, RNH2, H2O, alkoholid (veidi nõrgemad kui nende deprotonitud kujud).
- Erilised nukleofiilid: organometallilised ühendite reaktiivsed nukleofiilid (nt organolithium, Grignardi reaktiivid) — väga tugevalt reaktiivsed ja tihti häirivad protolüütilised lahustid.
Kuidas valida tingimusi nukleofiilseks reaktsiooniks
- Vali tugev või nõrk nukleofiil vastavalt mekanismile: SN2 soodustab tugev, väike ja mitte-steriline nukleofiil; SN1 puhul võib kasutada nõrgemaid nukleofiile ja stabiliseerivaid lahusteid.
- Lahusti valik: aprootilised lahustid suurendavad anioonsete nukleofiilide reaktiivsust (kasulik SN2 jaoks), prootilised lahustid võivad eelistada SN1-tüüpi käitumist.
- Lahkumisrühm: parem lahkumisrühm (nõrgem alus, näiteks tosüülaat või I– võrreldes OH–) soodustab nii SN1 kui SN2 protsesse.
Kokkuvõte
Nukleofiil on üldiselt elektronipaari loovutav aine, mis ründab positiivseid või elektronivaesemaid keskusi. Nukleofiilsust mõjutavad laeng, elektronegatiivsus, polariseeruvus, steriline takistus, resonants ja lahusti. Reaktsiooni tüüp (SN1, SN2, lisamine jms) ning praktiline käitumine sõltuvad nii nukleofiilist kui ka substraadist ja tingimustest. Arusaamine nukleofiilsuse ning baasilisuse erinevusest ja lahusti mõjust on orgaanilise sünteesi planeerimisel väga oluline.
Ajalugu
Terminid nukleofiil ja elektrofiil võttis 1929. aastal kasutusele Christopher Kelk Ingold, asendades A. J. Lapworthi poolt 1925. aastal välja pakutud terminid kationoid ja anionoid.
Sõna nukleofiil on tuletatud sõnast nucleus ja kreekakeelsest sõnast φιλος, filos, mis tähendab armastust.
Omadused
Üldiselt on perioodilisustabelis ühe rea sees seda reaktiivsem, mida aluselisem on ioon (mida kõrgem on konjugaathappe pKa), seda reaktiivsem on see nukleofiilina. Konkreetses rühmas on nukleofiilsuse määramisel tähtsam polariseeritavus. Teisisõnu, mida kergem on aatomi või molekuli ümber olev elektronipilv moonutada, seda kergemini reageerib see. Näiteks jodiidioon (I−) on nukleofiilsem kui fluoriidioon (F−).
Nukleofiilide tüübid
Nukleofiilid on näiteks anioonid, nagu Cl−, või ühendid, millel on üksik elektronpaar, nagu NH3 (ammoniaak).
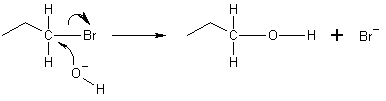
Allpool esitatud näites loovutab hüdroksiidiooni hapnik elektronpaari, et siduda bromopropaani molekuli lõpus oleva süsinikuga. Süsiniku ja broomi vaheline side läbib seejärel heterolüütilise lõhustumise, kusjuures broomi aatom võtab annetatud elektroni ja muutub bromiidiooniks (Br−). See on NS2-reaktsioon toimub tagantjärele rünnates. See tähendab, et hüdroksiidioon ründab süsiniku aatomi teiselt poolt, täpselt bromiiooni vastaspoolelt. Sellise tagumise rünnaku tõttu on NS2-reaktsiooni tulemuseks elektrofiili konfiguratsiooni ümberpööramine. Kui elektrofiil on kiraalne, säilitab ta tavaliselt oma kiraalsuse, kuigi NS2-toote konfiguratsioon on võrreldes algse elektrofiili konfiguratsiooniga ümberpööratud (Waldeni inversioon).
Ambidentne nukleofiil on selline nukleofiil, mis võib rünnata kahest või enamast kohast, mille tulemuseks on kaks või enam toodet. Näiteks tiotsüanaatioon (SCN−) võib rünnata kas S- või N-osast. Seetõttu tekib alküülhalogeniidi NS2-reaktsioon SCN-iga −sageli RSCN (alküültiotsüanaat) ja RNCS (alküülisotiotsüanaat) segu. Sarnased segud tekivad ka Kolbe nitriilide sünteesi käigus.
Süsiniku nukleofiilid
Alküülmetallide halogeniidid on süsiniku nukleofiilid, mida leidub Grignardi reaktsioonis, Blaise'i reaktsioonis, Reformatski reaktsioonis ja Barbier' reaktsioonis, organoliitiumreaktiivid ja terminalse alkiini anioonid.
Enoolid on samuti süsiniku nukleofiilid. Enooli moodustumist katalüüsib hape või alus. Enoolid on ambidentsed nukleofiilid, kuid üldiselt on nad nukleofiilsed süsiniku aatomi kõrval asuva süsiniku aatomi juures, millel on kaksikside (alfa süsiniku aatom). Enoole kasutatakse tavaliselt kondensatsioonireaktsioonides, sealhulgas Claiseni ja aldoolkondensatsiooni reaktsioonides.
Hapniku nukleofiilid
Hapnukleofiilide näited on vesi (2HO), hüdroksiid-anioon, alkoholid, alkoksiid-anioonid, vesinikperoksiid ja karboksülaat-anioonid.
Väävli nukleofiilid
Väävli nukleofiilidest kasutatakse kõige sagedamini vesiniksulfiidi ja selle soolasid, tioole (RSH), tioolaatanioone (RS−), tioolikarboksüülhapete anioone (RC(O)-S−) ning ditiokarbonaatide (RO-C(S)-S−) ja ditiokarbamaatide (2RN-C(S)-S−) anioone.
Üldiselt on väävel väga nukleofiilne, sest tänu oma suurele suurusele on ta kergesti polariseeruv ja tema üksikud elektronpaarid on kergesti ligipääsetavad.
Lämmastiku nukleofiilid
Lämmastiku nukleofiilide hulka kuuluvad ammoniaak, asiid, amiinid ja nitritid.
Seotud leheküljed
- Elektrofiilne
- Lewis'i baas
Küsimused ja vastused
K: Mis on nukleofiil?
V: Nukleofiil on liik, mis loovutab elektronpaari elektrofiilile, et moodustada reaktsioonis keemiline side.
K: Millist tüüpi molekulid või ioonid võivad olla nukleofiilid?
V: Kõik molekulid või ioonid, millel on vaba elektronpaar, võivad olla nukleofiilid.
K: Kuidas nimetatakse elektronipaari, mida nukleofiilid loovutavad?
V: Elektronipaari nimetatakse üksikpaariks.
K: Millisesse kategooriasse kuuluvad nukleofiilid?
V: Nukleofiilid kuuluvad Lewis'i aluste kategooriasse, sest nad loovutavad elektrone.
K: Mida kirjeldab mõiste "nukleofiilid"?
V: Mõiste "nukleofiilne" kirjeldab nukleofiili tõmbumist tuumade poole.
K: Mida tähistab mõiste "nukleofiilsus"?
V: Mõiste "nukleofiilsus" viitab aine nukleofiilsele iseloomule ja seda kasutatakse sageli aatomite atraktiivsuse võrdlemiseks.
K: Mis on "solvolüüsi" reaktsioonid?
V: Neutraalse nukleofiilsuse reaktsioone lahustitega, näiteks alkoholide ja veega, nimetatakse "solvolüüsiks".
Otsige