Perioodiline tabel: keemiliste elementide määratlus ja ülevaade
Avasta perioodiline tabel: keemiliste elementide paigutus aatominumbrite järgi, perioodid ja rühmad, metallid vs mittemetallid, IUPAC-i grupinimed ja Mendelejeviga seotud ajalugu.
Keemiliste elementide perioodilisustabel on kõikehõlmav nimekiri teadaolevatest keemilistest elementidest, mis on paigutatud nende aatominumbrite ehk aatomite prootonite arvu järgi. Aatominumber näitab, mitu prootonit on aatomituumas; see number määrab elemendi identiteedi. Perioodilisustabel kuvab elemente järjestatult ja tõstab esile mustrid ning korduvad keemilised omadused, mis tulenevad elektronide paigutusest aatomi ümber.
Perioodid ja rühmad
Perioodisüsteem on paigutatud perioodideks (horisontaalsed read) ja rühmadeks (vertikaalsed veerud). Praegune tunnustatud tabel sisaldab perioode numbritega 1–7. Perioodis olevad elemendid omavad järjestikuseid aatominumbreid. Näiteks esimeses perioodis on ainult kaks elementi: vesinik ja heelium. Teistes perioodides on rohkem elemente: periood 2 ja 3 sisaldavad kumbki 8 elementi, periood 4 ja 5 sisaldavad 18 elementi, periood 6 kuni 32 elementi (sellesse perioodi kuuluvad ka lantaaniidid) ning periood 7 sisaldab nii looduslikke kui ka sünteetilisi elemente, mille arv on samuti suur (sarnaselt perioodile 6 kuuluvad siia aktinoidid).
Tabeli vertikaalset veergu nimetatakse rühmaks. Tavapärases perioodilisustabelis on 18 rühma ja IUPAC-i reeglite järgi on need nummerdatud 1–18. Rühma elementidel on sageli sarnane elektronide väliskihipaigutus ehk valentsuselektronide arv, mis annab neile sarnased keemilised omadused. Näiteks on 18. rühma elemendid tuntud kui väärisgaasid — need on enamasti inertsed gaasid, mis väga vähe ühinevad teiste aatomitega.
Rühmasüsteemid ja ajalugu
On olemas kaks traditsioonilist grupinumbri süsteemi: vana süsteem rooma numbritega (I, II, III jne) ja uus IUPAC-i poolt soovitatud araabia numbrite süsteem (1–18). 1990. aastal otsustas Rahvusvaheline Puhta ja Rakenduskeemia Liit (IUPAC) kehtestada standardina araabia numbrid, et vältida segadust, mis tekkis vanade erinevate tähistuste vahel.
Elektronkonfiguratsioon, blokid ja keemilised omadused
Perioodilisuse põhjuseks on elektronide korrapärane täitumine energiatasandidel. Elementide omadused sõltuvad eelkõige valentsuselektronidest, mis osalevad keemilistes sidemetes. Perioodilisustabel jaguneb ka blokksüsteemi alusel:
- s-blokk (rühmad 1–2) — hõlmab nt alkali- ja leelismetalle;
- p-blokk (rühmad 13–18) — sisaldab mittemetalle, metalloidseid elemente ja väärisgaase;
- d-blokk ehk üleminekumetallid (rühmad 3–12);
- f-blokk — lantaaniidid ja aktinoidid, mis paigutatakse tavaliselt tabeli allosasse.
Need blokid peegeldavad, millisele alamhulgale järgmine elektron lisandub. Samuti selgitab see, miks rühma sees elemendid käituvad sarnaselt (nt kõik 1. rühma metallid annavad kergesti ühe elektroni ära ja moodustavad ühendeid sarnaste omadustega).
Perioodilised trendid
Perioodilisustabelist võib lugeda mitmeid üldiseid trende, mis on kasulikud elementide ja ühendite omaduste ennustamiseks:
- Aatomiraadius: suureneb rühmas allapoole liikudes ja väheneb perioodil vasakult paremale liikudes.
- Ioonimisenergia: üldjuhul suureneb perioodi vältel vasakult paremale ja väheneb rühmas allapoole minnes.
- Elektronegatiivsus: suureneb perioodi kaupa vasakult paremale ja väheneb rühmas allapoole; see mõjutab sidemete polaarsust.
- Metalsus: suurim vasakul ja alumistel positsioonidel; mitte-metallid paiknevad parempoolsetel rühmadel.
Neist seaduspärasustest tulenevad näiteks alkali- ja halogeenide tugev reaktiivsus ning väärisgaaside vähene reageerimisvõime. Siiski leidub erandeid ja erisusi: näiteks vesinik on eriline element ja tema asukoht tabelis tekitab vaidlusi — ta käitub mõnevõrra nii metallide kui ka mittemetallide moodi.
Lantaaniidid, aktinoidid ja sünteetilised elemendid
Molaarmassilt raskemad read (lantaaniidid ja aktinoidid) paigutatakse sageli tabeli alla, et säilitada tabeli selgus. Paljud aktinoidid ja kõrgema aatominumbriga elemendid on sünteetilised ja väga ebastabiilsed — nende tuumad lagunevad kiiresti radioaktiivselt. Praegu on ametlikult tuntud ja nimetud elemendid aatominumbrini 118 (Oganesson), kuid teadlased uurivad ka võimalusi teoreetiliselt raskemate elementide saamiseks.
Perioodilisustabeli kasutus ja tähtsus
Keemikud, materjaliteadlased, füüsikud ja insenerid kasutavad perioodilisustabelit igapäevatöö vahendina: see aitab ennustada ühendite struktuure, stabilisust, reaktsioonivõimet ja materjalide omadusi. Tabel on aluseks keemilistele valemitele, reaktsioonitasakaaludele ja uute ainete kavandamisele (nt katalüsaatorid, pooljuhid, legeerained).
Ajalugu — Mendelejev ja edasiarendus
Perioodilise tabeli varaseima ja kuulsama versiooni töötas välja vene keemik Dmitri Ivanovitš Mendelejev (1834–1907). Tema 1869. aasta tabel korrapärastas tuntud elementide omadused ja jättis teadlikult tühjad kohad veel avastamata elementidele, ennustades nende omadusi (nt "eka-alumiinium" jt). Tema töö näitas perioodilisuse sügavust ja aitas hiljem uute elementide avastustel. Tema auks nimetati üks hiljem avastatud elementidest mendelejiumiks.
Kokkuvõte
Perioodiline tabel on keemia keskne tööriist: see koondab elementide ajalise arengu, elektronkonfiguratsiooni ja keemilise käitumise ühte visuaalsesse ja loogilisse süsteemi. Tabeli mõistmine võimaldab seletada ja ennustada aineomadusi, sidemete tüüpe ning materjalide käitumist erinevates tingimustes. Kuigi tabeli põhistruktuur on püsiv, täieneb see koos uute elementide leidmise ja teoreetiliste arengutega ning võib tulevikus veel laieneda.
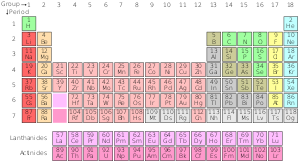
Perioodilise tabeli standardvariatsioon
Standardne perioodilisustabel
| Rühm → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 12 | 13 | 14 | 15 | 16 | 17 | ||||
| 1 | 2 | |||||||||||||||||||
| 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | ||||||||||||
| 3 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||
| 4 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 | ||
| 5 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 | 51 | 52 | 53 | 54 | ||
| 6 | 55 | 56 | * Lantaniidid | 72 | 73 | 74 | 75 | 76 | 77 | 78 | 79 | 80 | 81 | 82 | 83 | 84 | 85 | 86 | ||
| 7 | 87 Fr | 88 | ** Aktiniidid | 104 | 105 | 106 | 107 | 108 | 109 | 110 | 111 | 112 | 113 | 114 | 115 | 116 | 117 | 118 | ||
| 8 | 119 Uue | 120 Ubn | *** Superaktiniidid | |||||||||||||||||
| * Lantaniidide seeria | 57 | 58 | 59 | 60 | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 | 71 | |||||
| ** Aktiniidide seeria | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 | 101 | 102 | 103 | |||||
| *** Superaktiniidide seeria | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129Ube | 130Utn | 131Utu | 132Utb | 133Utt | 134Utq | 135Utp | |||||
| *** Superaktiniidide seeria | 136. | 137Uts | 138Uto | 139Ute | 140Uqn | 141Uqu | 142Uqb | 143Uqt | 144Uqq | 145Uqp | 146Uqh | 147Uqs | 148Uqo | 149Uqe | 150Upn | |||||
| *** Superaktiniidide seeria | 151Upu | 152Upb | 153Upt | 154Upq | 155Upp | 156Uph | 157Ups | 158Upo | 159Upe | 160Uhn | 161Uhu | 162Uhb | 163Uht | 164Uhq | 165Uhp | |||||
| *** Superaktiniidide seeria | 166Uhh | 167Uhs | 168Uho | 169Uhe | 170Usn | 171Usu | 172Usb | 173Ust | 174Usq | 175Usp | 176Ush | 177Uss | 178Uso | 179Kasutage | 180Uon | |||||
| *** Superaktiniidide seeria | 181Uou | 182Uob | 183Uot | 184Uoq | 185Uop | 186Uoh | 187Uos | 188Uoo | 189Uoe | 190Uen | 191Ueu | 192Ueb | 193Uet | 194Ueq | 195Uep | |||||
| *** Superaktiniidide seeria | 196Ueh | 197Ues | 198Ueo | 199Uee | 200Bnn | 201Bnu | 202Bnb | 203Bnt | 204Bnq | 205Bnp | 206Bnh | 207Bns | 208Bno | 209Bne | 210Bun | |||||
| *** Superaktiniidide seeria | 211Buu | 212Bub | 213 Aga | 214Buq | 215Bup | 216Buh | 217Bus | 218Buo | 219Bue | 220Bbn | 221Bbu | 222Bbb | 223Bbt | 224Bbq | 225Bbp | |||||
Perioodilise tabeli keemilised seeriad
- Leelismetallid
- Leelismuldmetallid
- Lantaniidid
- Aktiniidid
- Superaktiniidid
- Üleminekumetallid
- Kehvad metallid
- Mittemetallid
- Halogeenid
Seisund standardtemperatuuril ja -rõhul. Elemendi sümboli kohal oleva numbri (aatomiarv) värvus näitab elemendi olekut normaaltingimustes.
- sinise värviga on gaasid
- rohelise värviga on vedelikud
- musta värvi on tahked
- Need, millel on tahked piirid, on stabiilsed isotoobid (algsed elemendid).
- Need, mille piirid on katkendlikud, sisaldavad ainult looduslikult esinevaid radioaktiivseid isotoope.
- Need, millel on punktiirid, ei esine looduslikult (sünteetilised elemendid).
- need, millel ei ole piire, on liiga radioaktiivsed, et neid oleks veel avastatud.
Muud meetodid keemiliste elementide kuvamiseks
Eespool esitatud perioodilisustabel on kõige enam kasutatav versioon. Muud laialt levinud versioonid on esitatud allpool:
· 
Theodor Benfey paigutas elemendid spiraalselt ümber vesiniku. Aatomimass määrab elemendi positsiooni.
· 
Dmitri Ivanovitš Mendelejev kasutas lillede paigutust; aktiniidid, lantaniidid on kujutatud silmustena peagrupi kõrval.
· 
Timothy Stove paigutas elemendid kvantiarvude järgi.
· ![]()
Betterman paigutas elemendid nende isoelektriliste omaduste järgi, mida saab teisendada polünoomi kujul.
· 
Kolmnurkne versioon, mille on koostanud Zmaczynski ja Bayley.
· 
Korraldatud püramiidi kujul.
Vähem kasutatud versioonid
- Standardtabelis on esitatud põhitõed. See on näidatud eespool
- Vertikaalne tabel parema loetavuse tagamiseks veebibrauserites
- Suures tabelis on esitatud põhitõed ja täielikud elementide nimed.
- Suures tabelis on esitatud põhitõed ning elementide täielikud nimed ja aatommassid.
- Elektronide konfiguratsioonid
- Metallid ja mittemetallid
- Elementide nimekiri: sisaldab nime, sümbolit, aatomi numbrit, aatommassi, rühma ja perioodi; sorteeritav mis tahes nende järgi.
- Elementide loetelu sümbolite kaupa
- Elementide loetelu keemistemperatuuride järgi
- Elementide loetelu sulamistemperatuuri järgi
- Elementide loetelu tiheduse järgi
Seotud leheküljed
- Perioodilise tabeli rühm
- Perioodilise tabeli periood
- Laiendatud perioodilisustabel
Küsimused ja vastused
K: Mis on perioodilisustabel?
V: Perioodiline tabel on tabel, mis järjestab kõik teadaolevad keemilised elemendid nende aatominumbrite järjekorras, alustades vesinikuga number üks. Sarnaste omadustega elemendid paigutatakse sageli üksteise lähedale.
K: Mitu perioodi ja rühma on tavalises perioodilisustabelis?
V: Standardses perioodilisustabelis on 8 perioodi ja 18 rühma.
K: Mis on ühistel elementidel ühes perioodis ühist?
V: Perioodi elementidel on järjestikused aatominumbrid.
K: Mida ühist on elementidel rühmades?
V: Rühma elementidel on elektronid paigutatud sarnaselt, vastavalt väärtuselektronide arvule, mis annab neile sarnased keemilised omadused.
K: Kes leiutas perioodilisustabelit?
V: Perioodilise tabeli leiutas vene keemik Dmitri Ivanovitš Mendelejev (1834-1907).
K: Millised on kolm peamist rühma perioodilisussüsteemis?
V: Perioodilise tabeli kolm peamist rühma on metallid, metalloidid ja mittemetallid.
K: Kuidas saab perioodilisussüsteemi abil täheldada elementide vahelisi mustreid ja seoseid?
V: Elementide vahelisi mustreid ja seoseid saab vaadelda, kui vaadata, kus nad esinevad perioodilisussüsteemis; näiteks kalduvad elemendid, mis asuvad sellest vasakule allapoole, olema rohkem metallid kui need, mis asuvad paremal üleval.
Otsige