SN2: bimolekulaarne nukleofiilne asendamine – määratlus orgaanilises keemias
SN2: bimolekulaarne nukleofiilne asendamine – selge ülevaade mehhanismist, kineetikast, stereokemistriast ja näidetest orgaanilises keemias.
SN 2 reaktsioon (tuntud ka kui bimolekulaarne nukleofiilne asendamine) on orgaanilise keemia asendusreaktsioon. See on nukleofiilse asendamise tüüp, kus nukleofiili üksikpaar ründab elektronpuudulikku elektrofiilset keskust ja seob end sellega. See tõrjub välja teise rühma, mida nimetatakse "lahkuvaks rühmaks". Seega asendab sissetulev rühm lahkuva rühma ühe sammuga. Kuna reaktsiooni aeglases, kiirust määravas etapis on kaasatud kaks reageerivat liiki, siis on sellest tekkinud nimetus bimolekulaarne nukleofiilne asendamine ehk SN 2. Anorgaaniliste keemikute seas tuntakse SN 2 reaktsiooni sageli vahetusmehhanismina.
Mehhanism ja üleminekuolek
SN 2 toimub ühe sammuna: nukleofiil ründab substratsiooni elektrofiilset süsinikku otse vastassuunast (nn backside attack), samal ajal lahkub lahkuv rühm. Reaktsiooni üleminekuolek on korrapäratu pentakoordinaatne struktuur (osaline negatiivne laeng nii nukleofiilil kui ka lahkuval rühmal), mille korral sideme teke ja katkestamine toimuvad samaaegselt ilma eraldi vaheühendita.
Kineetika
SN 2 kineetika on teine järku: reaktsiooni kiirust määrab nii nukleofiili kui ka elektrooniliselt kahjustatud süsiniku kontsentratsioon. Kiiruseväljend:
- rate = k [substraat] [nukleofiil]
See tähendab, et kiirus muutub proportsionaalselt mõlema reageendi kontsentratsioonidega.
Stereokeemia
Tavaliselt SN 2 põhjustab Waldeni inversiooni — kui asendatav süsinik on stereoakesk, siis toimub konfiguratsiooni pöördumine (nt R → S). See on otsene tagajärg nukleofiili tagaajamisele ja tagumise rünnaku geomeetriale.
Mõjuvad tegurid
- Substraadi tüüp: SN 2 on kiireim primaarsetel ja metüülsetel süsinikel, aeglasem sekundaarsetel ning praktiliselt võimatu tertsiaarsetel — steriline takistus takistab backside attack'i.
- Nukleofiili tugevus: tugevam (rohkem laenguga või vähem delokaliseeritud) nukleofiil kiirendab SN 2. Negatiivsed ioonid (nt OH-, RS-) on tavaliselt tugevamad nukleofiilid kui neutraalsed molekulid.
- Lahkuva rühma kvaliteet: hea lahkuv rühm (nt I-, Br-, tosülaat) stabiliseerib lahkumisel saadavat laengut ja soodustab SN 2.
- Solvent: polar aprotic (nt DMSO, DMF, acetone) soodustavad SN 2, sest nad ei sidu tugevalt nukleofiile; protic (nt vee ja alkoholid) solvendid hääldavad tugevalt anioone H-sidemetega, nõrgendades nukleofiilide reaktiivsust.
- Temperatuur ja kontsentratsioon: kõrgem temp ja suuremad kontsentratsioonid kiirendavad üldiselt reaktsiooni.
Praktilised näited ja rakendused
- Methüülbromiid + OH- → metanol — lihtne metüül-substitutsiooni näide, mis kulgeb SN 2 teel.
- Alkoksüde (RO-) asendamine alküülsulfaadi või halogeniidiga, orgaanilises sünteesis kasutatavad funktsioonivahetused.
- SN 2 on lahutamatu osa paljudest sünteetilistest strateegiatest, näiteks heterotsüklite moodustamisel või kätteviimise astmel aktsepteeritud funktsionaalsuste asendamisel.
Võrdlus SN 2 vs SN 1 ja E2
- SN 1: toimub kaheastmelise mehhanismiga ja jälgib esimest järku kineetikat; SN 1 soodustub tertsiaarsetel süsinikel ja protic solventides; annab segatud stereokeemia (racemise) juhul, kui vaheühend on karbokatioon.
- E2: bimolekulaarne elimineerimine, samuti second-order kineetikaga; tihti konkureerib SN 2-ga, eriti sekundaarsete substratide ja tugevate basi/reaktiivsete nukleofiilide puhul; viimase korral tähtis on ka happe alfa-protoonide kättesaadavus ja geomeetriline nõue (anti-periplanaarne orientatsioon).
Energia- ja tööriistade märkused
SN 2-l on üks hästi defineeritud üleminekuolekule vastav energiatõus; reaktsiooni kiirus ja valikulisus sõltuvad ühestelt termodünaamilistest ja kineetilistest parameetritest (laengute stabiliseerimine, solvendi mõju, hüpoteetilised lahkuvate rühmade pKa-d jms). Reaktsioone modelleeritakse tihti DFT- või mehaanilise analüüsiga, et hinnata üleminekuolekuid ja energiabarjääre.
Kokkuvõte
SN 2 on lihtne, aga laialdaselt oluline orgaanilise keemia mehhanism, mille eripärad — bimolekulaarsus, teisest järku kineetika, backside attack ja Waldeni inversioon — määravad paljude sünteesistrateegiate valikulisuse ja efektiivsuse. Reaktsiooni edukus sõltub substraadist, nukleofiilist, lahkuvast rühmast ja solventist ning sageli tuleb arvestada konkurentsi teiste mehhanismidega nagu SN 1 ja E2.
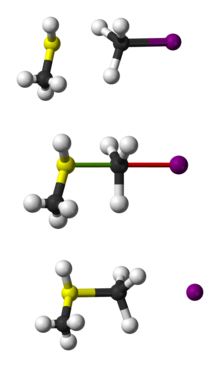
SN 2 CH3 SH ja CH3 I vahelise reaktsiooni S 2 kujutamine palli ja pulgaga.
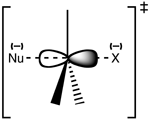
SN 2 ülemineku oleku struktuur 2
Reaktsioonimehhanism
Reaktsioon toimub kõige sagedamini alifaatilise sp3 süsiniku keskuse juures, mille külge on seotud elektronegatiivne, stabiilne lahkuv rühm - "X" - sageli halogeniidi aatom. C-X sideme purunemine ja uue C-Nu sideme moodustumine toimuvad samaaegselt, moodustades ülemineku seisundi, kus nukleofiilse rünnaku all olev süsinik on pentakoordinaatne ja ligikaudu sp2 hübriidne. Nukleofiil ründab süsinikku 180° nurga all lahkuva rühma suhtes, kuna see tagab parima kattuvuse nukleofiili üksiku paari ja C-X σ*-vastase sideme orbitaali vahel. Seejärel lükatakse lahkuv rühm vastasküljelt ära ja moodustub produkt.
Kui nukleofiilse rünnaku all olev substraat on kiraalne, võib see viia, kuigi mitte tingimata, stereokeemia inversioonini, mida nimetatakse Waldeni inversiooniks.
SN 2 -reaktsiooni näitel tekib OH −(nukleofiil) ja bromoetaani (elektrofiil) ründamisel etanool, kusjuures bromiid eraldub lahkuva rühmana:
SN 2 reaktsioon toimub, kui tagumine ründemarsruut ei ole molekuli teiste aatomite poolt blokeeritud (substitutsioonide poolt substraadil steriilselt takistatud). Seega toimub see mehhanism tavaliselt takistusteta primaarse süsiniku keskuse juures. Kui substraat on steriilselt piiratud lahkuvas rühmas, näiteks tertsiaarses süsiniku keskmes, kasutatakse substitutsioonis pigem SN 1 kui SN 2 mehhanismi (SN 1 oleks tõenäolisem ka blokeeritud molekulide puhul, sest võib tekkida piisavalt stabiilne karbokatsioonide vaheühend).
Koordineerimiskemias toimub assotsiatiivne asendamine sarnase mehhanismiga nagu SN 2.
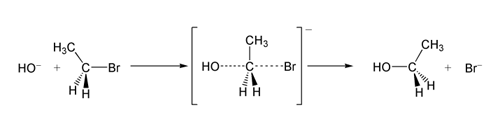
SN 2 bromoetaani reaktsioon hüdroksiidiooniga.
Reaktsiooni kiirust mõjutavad tegurid
Reaktsiooni kiirust mõjutavad neli tegurit:
- Substraat. Substraat mängib reaktsiooni kiiruse määramisel kõige olulisemat rolli. See on tingitud sellest, et nukleofiil ründab substraadi tagaküljelt, lõhkudes seelähedase rühma sideme ja moodustades süsiniku-nukleofiili sideme. Seetõttu peab SN 2 reaktsiooni kiiruse maksimeerimiseks olema substraadi tagakülg võimalikult takistusteta. Üldiselt tähendab see, et kõige kiiremini reageerivad metüül- ja primaarsubstraadid, millele järgnevad sekundaarsubstraadid. Tertsiaarsed substraadid ei osale SN 2 reaktsioonis, sest nad on steriilselt takistatud.
- Nukleofiil. Sarnaselt substraadiga mõjutab steroiline takistus nukleofiili tugevust. Näiteks metoksiidi anioon on nii tugev alus kui ka nukleofiil, sest see on metüülnukleofiil ja seega väga takistusteta. Tert-butoksiid seevastu on tugev alus, kuid kehv nukleofiil, sest kolm metüülrühma takistavad selle lähenemist süsinikule. Nukleofiili tugevust mõjutavad ka laeng ja elektronegatiivsus: nukleofiilsus suureneb negatiivse laengu suurenemisel ja elektronegatiivsuse vähenemisel. Näiteks OH- on parem nukleofiil kui vesi ja I- on parem nukleofiil kui Br- (polaarsetes protilistes lahustites). Polaarses aprotilises lahustis suureneb nukleofiilsus perioodilisustabelis veeru võrra ülespoole, kuna lahusti ja nukleofiili vahel puudub vesinikside. Sellisel juhul peegeldab nukleofiilsus aluselisust. I- oleks seega nõrgem nukleofiil kui Br- , sest see on nõrgem alus.
- Lahusti. Lahusti mõjutab reaktsiooni kiirust, sest lahustid võivad ümbritseda või mitte ümbritseda nukleofiili, takistades või mitte takistades seega selle lähenemist süsinikuaatomile. Polaarsed aprotilised lahustid, nagu tetrahüdrofuraan, on selle reaktsiooni jaoks paremad lahustid kui polaarsed protilised lahustid, sest polaarsed protilised lahustid lahustuvad, kuna lahusti vesiniksidemed seonduvad nukleofiiliga. See takistab selle ründamist süsiniku lahkumisrühmaga.
- Rühmast lahkumine. Lahkuv rühm mõjutab reaktsiooni kiirust. Mida stabiilsem on lahkuv rühm, seda tõenäolisemalt võtab see süsiniku lahkuvale rühmale kaks elektroni sideme, kui nukleofiil ründab süsinikku. Seega, mida nõrgem on lahkuv rühm kui konjugeeritud alus, seda parem on lahkuv rühm. Samamoodi, mida tugevam on selle vastav hape, seda parem on lahkuv rühm. Head lahkuva rühma näited on halogeniidid (v.a fluoriid) ja tosülaat. Kuid HO- ja H2 N- ei ole head lahustuvad rühmad.
Reaktsiooni kineetika
SN 2 reaktsiooni kiirus on teise järjekorra, kuna kiirust määrava sammu kiirus sõltub nii nukleofiili kontsentratsioonist [Nu− ] kui ka substraadi kontsentratsioonist [RX].
r = k[RX][Nu− ]
See on peamine erinevus mehhanismide SN 1 ja SN 2 vahel. SN 1 reaktsioonis ründab nukleofiil pärast kiirust piirava etapi lõppu. Kuid SN 2 reaktsioonis sunnib nukleofiil lahkuvat rühma ära võtma piiraval etapil. Teisisõnu sõltub SN 1 reaktsiooni kiirus ainult substraadi kontsentratsioonist, samas kui SN 2 reaktsiooni kiirus sõltub nii substraadi kui ka nukleofiili kontsentratsioonist. Juhul, kui mõlemad mehhanismid on võimalikud (näiteks sekundaarse süsiniku keskuse juures), sõltub mehhanism lahustist, temperatuurist, nukleofiili kontsentratsioonist või lahkuva rühma kontsentratsioonist.
SN 2 reaktsioonid on üldiselt soodsad primaarsetes alküülhalogeniidides või sekundaarsetes alküülhalogeniidides koos aprotilise lahustiga. Tertsiaarsetes alküülhalogeniidides toimuvad need steroobse takistuse tõttu väheoluliselt.
SN 2 ja SN 1 on kaks äärmuslikku reaktsiooni libisevas skaalas. On võimalik leida palju reaktsioone, mille mehhanismides esineb nii SN 2 kui ka SN 1 iseloomu. Näiteks on võimalik, et alküülhalogeniidist moodustuvad kontaktioonipaarid, milles ioonid ei ole täielikult eraldatud. Kui need substitutsiooni läbivad, on stereokeemia paljude reageerivate molekulide puhul inverteeritud (nagu SN 2), kuid mõnedel võib esineda konfiguratsiooni säilimine. SN 2 reaktsioonid on sagedasemad kui SN 1 reaktsioonid.
E2 konkurents
SN 2 reaktsioonide puhul toimub sageli kõrvalreaktsioon E2 eliminatsioon: sissetulev anioon võib toimida pigem alusena kui nukleofiilina, eemaldades prootoni ja viies alkeeni moodustumiseni. Seda efekti saab demonstreerida gaasifaasis toimuva reaktsiooni puhul sulfonaadi ja lihtsa alküülbromiidi vahel, mis toimub massispektromeetris:

Etüülbromiidi puhul on reaktsiooniprodukt valdavalt asendusprodukt. Kui elektrofiilse keskuse ümber suureneb steroiline takistus, nagu isobutüülbromiidi puhul, on substitutsioon ebasoodne ja domineerivaks reaktsiooniks on eliminatsioon. Muud eliminatsiooni soodustavad tegurid on aluse tugevus. Vähem aluselise bensoaadi substraadiga reageerib isopropüülbromiid 55%-lise asendusega. Üldiselt järgivad seda tüüpi gaasifaasi reaktsioonid ja lahusfaasi reaktsioonid samu suundumusi, kuigi esimese puhul on lahusti mõju ära langenud.
Ümberkäigumehhanism
Üks 2008. aastal tähelepanu äratanud areng puudutab SN 2 ringmehhanismi, mida täheldati gaasifaasis toimuvas reaktsioonis kloriidioonide ja metüüljodiidi vahel spetsiaalse tehnika abil, mida nimetatakse ristatud molekulaarikiirte kujutamiseks (crossed molecular beam imaging). Kui kloriidioonidel on piisav kiirus, on tekkinud jodiidiioonide energia pärast kokkupõrget oodatust palju väiksem ja teoorias on oletatud, et energia kaob metüülrühma täieliku ringkäigu tõttu ümber joodi aatomi enne tegelikku nihkumist.
Seotud leheküljed
- Asendusreaktsioon
- SN 1 reaktsioon
Küsimused ja vastused
K: Mis on SN2-reaktsioon?
V: SN2-reaktsioon on asendusreaktsioon orgaanilises keemias, kus nukleofiil ründab elektronpuudulikku elektrofiilset keskust, tõrjudes välja lahkuva rühma ja asendades selle seejärel ühes etapis.
K: Milline asendusreaktsioon on SN2-reaktsioon?
V: SN2-reaktsioon on üks nukleofiilse asendusreaktsiooni tüüp.
K: Mitu reageerivat liiki osaleb SN2-reaktsiooni aeglases, kiirust määravas etapis?
V: SN2-reaktsiooni aeglases, kiirust määravas etapis osaleb kaks reageerivat liiki.
K: Mida tähendab SN2-reaktsiooni nimetus "bimolekulaarne nukleofiilne asendamine"?
V: SN2-reaktsiooni nimetus "bimolekulaarne nukleofiilne asendamine" viitab asjaolule, et reaktsiooni aeglases, kiirust määravas etapis osalevad kaks reageerivat liiki.
K: Mis on SN2-reaktsiooni kontekstis nukleofiil?
V: Nukleofiil on molekul või ioon, mis loovutab keemilise sideme moodustamiseks üksiku elektronpaari.
K: Mis on SN2-reaktsiooni kontekstis elektrofiil?
V: Elektrofiil on molekul või ioon, mis võtab keemilise sideme moodustamiseks vastu elektronpaari.
K: Mis on anorgaaniliste keemikute seas sageli tuntud SN2-reaktsioon?
V: Anorgaaniliste keemikute seas tuntakse SN2-reaktsiooni sageli kui vahetusmehhanismi.
Otsige