Reaktsioonimehhanism: definitsioon, etapid ja näited keemias
Reaktsioonimehhanism: selgitus, etapid ja praktilised näited keemias — õpi vaheprodukte, üleminekuolekuid ja levinumaid mehhanisme samm-sammult.
Reaktsioonimehhanism on keemilise reaktsiooni toimimisviisi samm-sammult kirjeldamine. Tavaliselt on reaktsioonis nähtav vaid üldine muutus (näiteks A → B), kuid reaalses elus koosneb see muutus sageli mitmest elementaarsammust. Vahepealsed olevused reageerivad liiga kiiresti või esinevad liiga madalate kontsentratsioonidena, et neid lihtsasti näha; neid nimetatakse vaheproduktideks ja ühelt vaheproduktilt teisele minnes läbitakse ülemineku olek. Oluline on mõista kõiki etappe, mis moodustavad kogu muutuse, sest see võimaldab selgitada reaktsiooni kiirust, suunata selektiivsust (milline produkt tekib) ja planeerida katalüütilisi või tingimuslikke muutusi reaktsiooni parendamiseks.
Reaktsiooni etapid ja põhitingimused
Reaktsioonimehhanismi kirjeldamiseks kasutatakse mõisteid, mida tasub eraldi lahti seletada:
- Elementaarsamm – üks samm, mis toimub ühe kokkupuutena molekulide vahel ja mille saab otseselt seostada keemilise võrrandiga (näiteks bimolekulaarne samm).
- Vaheprodukt – lühiajaline, sageli reaktiivne ühend, mis tekib ühe sammu lõpus ja reageerib edasi järgmises sammus (vaheproduktid võivad olla nt karbokatioonid, radikaalid, tioestrid jne).
- Üleminekuolek – maksimumenergia punkt reaktsiooni koordinatiivsel teekonnal; seda ei saa otseselt isoleerida, kuid selle olemasolu määrab aktivatsioonienergia.
- Kiiruse määrav samm – reaktsiooniketis kõige aeglasem samm, mis määrab kogu reaktsiooni kiiruse.
- Molekulaarsus – elementaarse sammu alustavate osakeste arv (unimolekulaarne, bimolekulaarne jms), mis mõjutab kiirusseadust.
Tüüpilised orgaanilised mehhanismid ja näited
Orgaanilises keemias esineb palju eri mehhanisme; levinumate hulka kuuluvad nukleofiilne asendamine, eliminatsioon ja liitumine. Siin mõned olulised näited ja nende omadused:
- SN2 (bimolekulaarne nukleofiilne asendamine): üheastmeline mehhanism, kus nukleofiil ründab elektrooniliselt vaest süsinikku samal ajal, kui lahkuv rühm lahkub. Tulemuseks on stereokeemiline inversioon (Walden’i inversioon).
- SN1 (unimolekulaarne nukleofiilne asendamine): kaheastmeline protsess, kus esmalt tekib karbokatioon (vaheprodukt) ning seejärel nukleofiil liitub. Sageli viib see racemise või osalise racemise tekkeni, kuna karbokatioon on sp2-hübriidne ja plaaniline.
- E2 (bimolekulaarne eliminatsioon): üheastmeline eliminatsioon, kus baas eemaldab prootonit samaaegselt, kui lahkuv rühm lahkub; stereokeemiliselt on oluline anti-periplanaarne positsioon kahe eemaldatava aatomi vahel.
- E1 (unimolekulaarne eliminatsioon): sarnane SN1-ga, algab karbokatiooni tekkel ja lõpeb prootoni eemaldamisega; sageli kaasneb konkurents SN1 protsessiga.
- Radikaalmehhanismid: loovad ja hävitavad radikaale (nt keti algus, keti pikendamine, terminatsioon); typiline näide on halogenatsioon (nt metaani kloorimine) või radikaalne liitmine alteenidele.
- Liitumisreaktsioonid: alkeenide ja alkaanide liitumised (nt elektrofiilne liitumine, radikaalne liitumine), millel võivad olla regio- ja stereoelektrilised reeglid (Markovnikovi reeglid, anti-Markovnikovi radikaalne käik).
- Periüklilised ja kontsertsed reaktsioonid (nt Diels–Alder): samm on korraga mitme sideme ümberkorraldus; ei läbi isoleeritavaid vaheprodukte.
Energiamuutused ja reaktsiooni koordinaat
Reaktsiooni mehhanismi mõistmiseks on kasulik vaadata reaktsioonikoordinaadi diagrammi, kus energia on joonistatud reaktsiooni edenemise (koordinaadi) funktsioonina. Diagrammil on tavaliselt mitu lokaalset maksimumi (üleminekuolekud) ja lokaalsed miinimumid (vaheproduktid). Kõrgeim energiline takistus määrab aktivatsioonienergia ja seega kiiruse. Katalüsaatorid madaldavad teatud üleülemineku oleku energiat, muutes reaktsiooniteed või kiirust ilma jäävat toodet oluliselt muutmata.
Kinetika, termodünaamika ja kontroll
Tuleb eristada kinetilist kontrolli (milles tekib esimesena kiirem produkt ehk madalaima aktivatsioonienergiaga tee) ja termodünaamilist kontrolli (milles lõpuks domineerib stabiilseim produkt). Temperatuur, lahusti, kontsentratsioonid ja katalüsaatorid mõjutavad, milline kontroll on määrav. Kiiruseseadused ja reaktsioonijärjekord aitavad määrata elementaarsete sammude molekulaarsust ning leida kiiruse määravat sammu.
Kuidas mehhanisme uuritakse
Mehhanismide määramiseks kasutatakse mitmeid eksperimentaalseid ja teoreetilisi meetodeid:
- Kineetilised mõõtmised (kiiruse seadused, sõltuvus kontsentratsioonist ja temperatuurist).
- Isotoopia märgistamine (nt deutereerimine) ja KIE (kinetic isotope effect), mis annavad teavet, kas prootonide eemaldamine on kiiruse määrav samm.
- Spektroskoopilised meetodid (NMR, IR, UV–Vis, massa-spektromeetria) vaheproduktide püüdmiseks või jälgimiseks.
- Radikaali- või vaheproduktide peet mine (trapping) kemikaalidega, mis annavad isoleeritavaid derivaate.
- Arvutuskeemia ja teoreetilised potentsiaalpinna arvutused, mis prognoosivad üleminekuolekuid ja energiaid.
Noolega tõukamise reeglid ja praktilised näpunäited
Keemikuid õpetatakse sageli elektronide liikumist nooltel näitama. Mõned hea tava reeglid:
- Kasutage noolt, mis lähtub elektronipaarist või -tihedusest ja osutab elektrofiilse süsiniku või aatomi poole.
- Joonistage kogu samm: milline side tekib ja milline puruneb—see aitab vältida ebaloogilisi lugemisi.
- Ärge joonistage nooleotsana „elektroni” kui positiivse laengu liikumist; nool näitab elektronpaari või üksikute elektronide liikumist.
- Tõstke esile stereokemiat: kas toimub inversioon, racemise või säilib konfiguratsioon?
Olulisus ja praktilised rakendused
Reaktsioonimehhanismide mõistmine on hädavajalik sünteetilises orgaanikas, farmaatsiatööstuses, katalüüsis ja biokeemias. Näiteks mehhanismi tundmine võimaldab:
- disainida selektiivsemaid sünteesiteid ja vältida kõrvalreaktsioone,
- arendada tõhusamaid katalüsaatoreid (sh ensümaatilisi mehhanisme mõistmine biokatalüüsis),
- opteimeerida reaktsioonitingimusi (lahusti, temperatuur, kontsentratsioon) ja paremini skaleerida protsesse tööstuslikuks kasutamiseks.
Lõpetuseks: reaktsioonimehhanism ei ole ainult "moraalne seletus" sellele, mis toimub — see on praktiline tööriist, mis aitab prognoosida ja juhtida keemilisi protsesse. Hea mehhanistlik vaade muudab keerulised reaktsioonid arusaadavaks ja annab võimaluse uusi, tõhusamaid ning selektiivsemaid reaktsioone välja töötada.
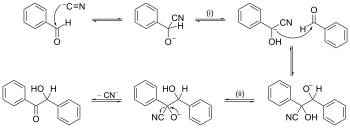
Näide reaktsioonimehhanismi kohta noole lükkamisega
Küsimused ja vastused
K: Mis on reaktsioonimehhanism?
V: Reaktsioonimehhanism on keemilise reaktsiooni toimumise samm-sammuline selgitus.
K: Miks on oluline mõista kõiki reaktsioonimehhanismi etappe?
V: On oluline mõista kõiki reaktsioonimehhanismi samme, et mõista keerulisi reaktsioone või püüda reaktsiooni teatud viisil toimima panna.
K: Mis on keemilise reaktsiooni vaheproduktid?
V: Vaheproduktid on asjad, mis tekivad vahepealsetes reaktsioonides liiga kiiresti, et neid keemilises reaktsioonis näha.
K: Mis on keemilises reaktsioonis ülemineku olek?
V: Üleminekusseisundis minnakse keemilise reaktsiooni käigus ühest vaheproduktist teise.
K: Millised on levinumad reaktsioonimehhanismid orgaanilises keemias?
V: Kõige tavalisemad reaktsioonimehhanismid orgaanilises keemias on nukleofiilne asendamine, eliminatsioon ja liitumine.
K: Mis on keemilise reaktsioonimehhanismi nooltõukamine?
V: Noolte lükkamist kasutatakse mõnikord selleks, et joonistada, kuidas elektronid reaktsiooni käigus liiguvad. Nii on lihtne näha, millised sidemed moodustuvad ja millised purunevad protsessi käigus.
K: Millist teavet saab reaktsioonimehhanismi mõistmisest?
V: Reaktsioonimehhanismi mõistmine võib anda teavet selle kohta, kuidas reaktsioon toimida soovitud viisil või kuidas mõista keerulisemaid reaktsioone.
Otsige