Üleminekuseisund keemias: määratlus, aktiveerimisenergia ja tähtsus
Avasta üleminekuseisundi mõiste, aktiveerimisenergia roll ja tähtsus reaktsioonimehhanismide mõistmisel – selgitused, näited ja uurimismeetodid keemias.
Keemilises reaktsioonis on ülemineku olek (ingl. transition state) see punkt reaktsiooni energiaprofiilil, kus süsteemi potentsiaalne energia on maksimaalne. Seda energiat, mida tuleb reaktiividel saavutada, et reaktsioon saaks toimuda, nimetatakse aktiveerimisenergiaks. Ülemineku oleku juures on elektronilise ümberkorralduse käigus osaliselt loodud uued sidemed ja osaliselt lõhkunud vanad sidemed — see seisund on seetõttu väga lühiajaline ja ebastabiilne. Graafikul või joonisel tähistatakse ülemineku olekut sageli topelttikandiga ‡.
Mida tähendab „ülemineku olek” täpsemalt?
Füüsikalis-keemiliselt on ülemineku olek potentsiaalse energia pinna (potential energy surface) esimese järgu sadulpunkt (first-order saddle point): see on punkt, kus energia on maksimaalne mööda reaktsioonikoordinaati, kuid miinimumlikud variatsioonid on võimalikud teistes suundades. Praktikas tähendab see, et molekuli struktuur ülemineku olekus ei ole normaalse stabiilse molekuli struktuur — sidemed on „poolik” ja atompositsioonid sageli üleminekumenetluse eeltingimuses.
Aktiveerimisenergia ja reaktsioonikiirus
Aktiveerimisenergia (E_a või ΔG‡ sõltuvalt sellest, kas vaadeldakse enthalpiat või vabaenergiat) on energiaerinevus reaktiivide baastaseme ja ülemineku oleku vahel. Suurem aktiveerimisenergia tähendab tavaliselt aeglasemat reaktsiooni, sest väiksem osa molekulidest omab reaktiivset tempel piisaval energiatasemel. Reaktsioonikiiruse kirjeldamisel kasutatakse nii Arrheniuse seadust kui ka Eyringi (üleminekuoleku) teooriat, mille järgi on kiiruskonstant seotud ülemineku oleku vabaenergiaga (ΔG‡) läbi faktoriga (k_B T / h)·e^(−ΔG‡/RT).
Ülemineku olek vs vaheprodukt
Oluline on mitte segi ajada ülemineku olekut vahepealsetega. Põhilised erinevused:
- Ülemineku olek on koheselt mööduv, pole isoleeritav ja asub energiaprofiilil maksimumis (sadulpunkt).
- Vaheprodukt on stabiilsem struktuur, mis paikneb energiaprofiilil miinimumis ja võib eksisteerida pikal ajaskaalal (sekunditest edasi kuni kauem), seda on tihti võimalik isoleerida või karakteriseerida.
Uurimisviisid ja meetodid
Üleminekuseisundite otsene uurimine on väga keeruline, sest nende eluaeg on sageli femtosekundites (10^−15 s). Siiski saab nende olemust ja omadusi määrata mitmel viisil:
- Kvantkeemilised arvutused (ab initio, DFT jt) — võimaldavad leida potentsiaalse energia sadulpunkte, arvutada ΔG‡ ja prognoosida geomeetriat.
- Reaktsioonikiiruse mõõtmised ja kineetilised isotoopmõjud — annavad informatsiooni sidemete ümberkorralduste kohta ülemineku olekus.
- Kiire spektroskoopia (näiteks löögilaineline või femtosekundiline spektroskoopia) — võib jälgida esialgseid elektronilisi ja vibratsioonilisi muutusi väga lühikeste ajaskaalade jooksul.
- Arvutuslikud meetodid nagu intrinsic reaction coordinate (IRC) ja nudged elastic band — aitavad modelleerida reaktsiooniteekonda reaktiividest produktideni ja tuvastada üleminekuolekuid.
Kuigi üleminekuseisundeid ei saa tavaliselt „kinni püüda”, on arvutuslikud mudelid ja eksperimentaalsed andmed koos väga võimsad vahendid selle struktuuri ja energiakõvera mõistmiseks.
Tähtsus keemias ja katalüüsis
Ülemineku olekute mõistmine on reaktsioonimehhanismide lahtimuukimise ja reaktsioonikiiruste ennustamise seisukohalt ülioluline. Näited olulisusest:
- Katalüsaatorid (sh ensüümid) ei muuda reaktsiooni tasakaalu, kuid kiirendavad reaktsioone, stabiliseerides või madaldades ülemineku olekut, seeläbi vähendades aktiveerimisenergiat.
- Keemilises sünteesis võimaldab üleminekuolekute mõistmine valida tingimusi ja katalüsaatoreid, mis suurendavad selektiivsust ja tootlikkust.
- Stereokeemilised tulemused (nt asümmeetriline süntees) on tihti määratud üleminekuoleku geomeetriaga — väikesed energiavahed erinevate üleminekuolekute vahel võivad viia erinevate stereoisomeeride eelistumiseni.
Konkreetsemad näited
SN2-reaktsiooni puhul kujuneb ülemineku olek, kus lahkuv rühm ja sissetungiv nukleofiil on samaaegselt seotud süsinikuga — see on klassikaline „pool-teeniv” topelt-sidemeta struktuur. Perioksüdaalsed ja peritsüklilised reaktsioonid kulgevad sageli üheainsa üleminekuoleku kaudu (kontserteeritud mehhanism), samas kui komplekssemad liinid võivad kulgeda mitme vaheastme ja mitme üleminekuoleku kaudu.
Kokkuvõte
Ülemineku olek on keemilise reaktsiooni kriitiline hetk — kitsaskoht, mis määrab, kui kiiresti ja kuidas reaktsioon kulgeb. Kuigi seda seisundit on raske otse vaadelda, annavad tänapäevased teoreetilised ja eksperimentaalsed tööriistad hea võimaluse selle struktuuri ja rolli mõistmiseks. See teadmine on praktiline nii laborisünteesis, katalüüsis kui ka biokeemias ning on aluseks keemia kineetikale (keemilisele kineetikale) ja reaktsioonimehhanismide uurimisele.
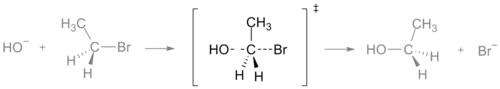
SN2-reaktsiooni ülemineku seisund
Küsimused ja vastused
K: Mis on keemilise reaktsiooni ülemineku seisund?
V: Ülemineku seisund on punkt, kus keemilises reaktsioonis on energia maksimaalne väärtus.
K: Mis on aktiveerimisenergia keemilises reaktsioonis?
V: Energiat, mis on vajalik reaktsiooni toimumiseks, nimetatakse aktiveerimisenergiaks.
K: Mis juhtub, kui kaks või enam molekuli segunevad keemilises reaktsioonis?
V: Kui kaks või enam molekuli segunevad, põrkuvad nad üksteisega kokku. Kui nad põrkuvad piisavalt suure energiaga, et läbida ülemineku seisund, reageerivad nad ja moodustavad uusi molekule.
K: Milleks kasutatakse keemilise reaktsiooni graafikul või joonisel topeltdolm (‡)?
V: Kahekordse tikri (‡) sümbolit kasutatakse keemilise reaktsiooni graafikul või joonisel ülemineku oleku tähistamiseks.
K: Miks on keemilise reaktsiooni ülemineku oleku uurimine keeruline?
V: Keemilises reaktsioonis on ülemineku olekut väga raske uurida, sest selle energia on nii suur, et molekulid jäävad sellesse vormi väga lühikeseks ajaks, tavaliselt femtosekunditeks.
K: Mis on keemilise reaktsiooni vaheprodukt?
V: Vaheprodukt on molekul, mis asub keemilises reaktsioonis minimaalsetes energiapunktides ja võib elada väga pikka aega.
K: Miks on reaktsioonimehhanismide mõistmisel oluline uurida üleminekusseisundeid?
V: Üleminekusseisundite uurimine on reaktsioonimehhanismide mõistmisel oluline, sest see aitab kindlaks teha, kuidas reaktsioon toimub ja kuidas seda kontrollida või manipuleerida.
Otsige