Karbokatsioonid: määratlus, struktuur, hübridisatsioon ja reaktiivsus
Karbokatsioonid: selge määratlus, struktuuri ja hübridisatsiooni selgitus ning sügav ülevaade reaktiivsusest, stabiliseerimisest ja reaktsioonimehhanismidest keemias.
Karbokatsioon on ioon, millel on positiivselt laetud süsinikuaatom. Sellise süsiniku aatomi välisvalentsuskoores on kaheksa valentselektroni asemel ainult kuus elektroni (st tegemist on nii‑öelda elektronilise "sekstetiga"), mistõttu välisvalentsuskoores puudub täisoktett. Okteti reegli järgi on kaheksa valents‑elektroniga süsinikuid stabiilsem—seetõttu on karbokatioonid sageli väga reaktiivsed ja püüdlevad elektronide juurde, et taastada neutraalne laeng.
Struktuur ja hübridisatsioon
Kuigi intuitiivselt võiks oletada, et positiivselt laetud süsinik on 3sp‑hübriidunud (st neli sidet, tetraeedriline), on karbokatioonide reaalne geomeetria tavaliselt teistsugune. Enamik klassikalisi karbokatione on sp2‑hübriidunud ja omavad trigonaalset planaarset geomeetriat: kolm σ‑sidet paiknevad ühes tasapinnas ja tühi p‑orbitaal, mis kannab positiivset laengut, on selle tasapinnaga risti. See tühi p‑orbitaal on karbokatiooni reaktiivsuse ja stabilisatsiooni keskne tunnus.
Stabiilsus: mis teeb karbokatiooni stabiilsemaks?
- Alküüliastme mõju: üldine järjestus stabiilsusest on tertsiaarne > sekundaarne > primaarsed > metüül. Mida rohkem alküülrühmi kationi küljes, seda paremini stabiliseerib see positiivset laengut hyperkonjugatsiooni ja indutseeritud elektronidoonuse kaudu.
- Hyperkonjugatsioon: läheduses olevad C–H või C–C σ‑sidemed võivad osaliselt delokaliseerida elektronitihedust tühja p‑orbitaali kaudu, mis stabiliseerib laengut.
- Resonantsi stabilisatsioon: benzüül- ja alüülikarbokationid (st benžeensüsteemide või konjugeeritud alkeenide läheduses) võivad positiivse laengu delokaliseerida π‑süsteemi kaudu, mistõttu need võivad olla tertsiaarsetest isegi stabiilsemad.
- Induktiivne efekt: elektronidoonivad rühmad suurendavad stabiilsust, elektronitõmbavad rühmad vähendavad seda.
- Lahusti ja anioon: polaarne lahusti ning nõrgalt koordineeruvad anioonid (nt BF4−, PF6−) aitavad kationit stabiliseerida ja vähendavad hüdratatsioonist või koordinatsioonist tingitud rekombinatsiooni.
Tekkimine ja tüüpilised reaktsiooniteed
Karbokationid tekivad mitmel viisil, näiteks:
- hõlpeline heterolüütiline sideme lõhkemine (nt halogeenide lahkumisel) — tüüpiline SN1‑mehanism;
- alkeenide protonatsioon, mis jätkab nukleofiilse lisandiga (nt H+ lisamisel → karbokation → nukleofiililine rünnak);
- elektrofiilne lisandumine ja redutseerumine erinevates orgaanilistes reaktsioonides;
- mõned oksüdeerimisreaktsioonid ja fotokeemilised protsessid.
Reaktiivsus ja tavalised reaktsioonid
Karbokationid on tugevad elektrofiilid. Peamised reaktsioonitüübid:
- Nukleofiilne rünnak: nukleofiilid (vesi, alkoholid, halogeniidid jms) annavad karbokationile elektrone ja moodustavad asendustooteid (SN1).
- Rearranžeerumised: karbokationid läbivad sageli hüdriid‑ või alküüli‑nihkeid (sh 1,2‑nihked), et kujuneda stabiilsemaks karbokationiks — see on tavaline allikas ootamatutele toodetele.
- Eliimineerumine: karbokation võib kaotada prootoni, andes alkeeni (E1‑mehanism).
- Polümerisatsioon: alkeenide karbokationiline läbikäik võib viia polümerisatsioonini (nt isobuteen → polüisobuteen).
Erandid ja eriliigid
- Aromaatsed karbokationid: näiteks tropüüliumioon (C7H7+) on aromaatne ja seetõttu eriti stabiilne — siin on laeng delokaliseerunud üle tsüklilise π‑süsteemi.
- Mitteklassikalised karbokationid: mõned karbokationid (nt norbornüüli‑tüüpi) näitavad silumisest tingitud sidemete jaotumist, kus laeng ei ole lokaliseeritud ühel aatomil vaid jaotub läbi "sillatatud" struktuuri. Seda on uuritud ja vaidlustatud kogu ajaloo vältel organilise keemia alal.
- Stabiliseeritud ja isoleeritud karbokationid: väga stabiliseeritud juhtudel on võimalik karbokatione isoleerida ja karbocation‑soolasid karakteriseerida, eriti kui kasutatakse nõrgalt koordineeruvaid anioone ja lahusteid.
Tuvastamine ja eksperimendilised meetodid
Karbokatione uuritakse mitmete meetoditega: NMR‑spektroskoopia (tugevalt nihkunud signaalid karbokatioonide tuumadele), UV/VIS, massspektromeetria, ning kiirresponssed ultarapidad etapisisene tuvastamine fotokeemias. Paljusid tüüpilisi karbokationeid saab ka vahetult "püüda" nukleofiilidega ja seeläbi kinnitada tekkivad tooted.
Praktilised märkused
- Karbokationite teke ja käitumine mõjutavad tugevalt reaktsiooni tingimusi: lahusti, temperatuur, nukleofiili kontsentratsioon ja lahustunud anionid võivad muuta reaktsiooniteed (SN1 vs SN2, E1 vs E2 jne).
- Rearranžeerumiste oht tuleb planeerides reaktsioone arvestada — sageli annab oodatust erineva regio‑ või stereokeemia.
Kokkuvõtlikult: karbokatioonid on positiivselt laetud süsinikuaatomiga tsementeeritud keskseid elektrofiile, mille struktuuriks on enamasti sp2‑hübriidunud, trigonaalne planaarne geomeetria ja tühi p‑orbitaal. Nende stabiilsust ja reaktiivsust määravad hyperkonjugatsioon, resonants, induktiivne efekt ning lahusti‑ ja anioonitegurid.
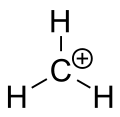
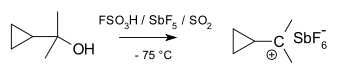
Metaani karbeniumioon

tert-butüülkatsioon, mis näitab planaarset geomeetriat
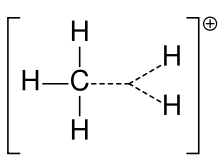
Metaani karboniumioon
Definitsioonid
Karbokatsiooni nimetati varem sageli karboniumiooniks, kuid keemikud seavad selle täpse tähenduse kahtluse alla. Tänapäeva keemias on karbokatioon iga positiivselt laetud süsinikuaatom. On pakutud välja kaks eritüüpi: karbeniumioonid on kolmevalentsed ja karbooniumioonid on viie- või kuuevalentsed. Ülikoolide tasemel õpikutes arutatakse karbokatsioone ainult nii, nagu oleksid need karbeniumioonid, või arutatakse karbokatsioone põgusalt viidates vanemale väljendile karboniumioon või karbenium- ja karboniumioonid. Üks õpik jääb tänaseni karbeniumiooni puhul vanema nimetuse karbooniumioon juurde ja reserveerib fraasi hüpervalentne karbeniumioon CH5+ jaoks.
Ajalugu
1891. aastal teatas G. Merling, et ta lisas tropülideenile (tsükloheptatrieenile) broomi ja seejärel kuumutas toodet, et saada kristalliline, vees lahustuv materjal, C
7H
7Br. Ta ei pakkunud sellele struktuuri; Doering ja Knox näitasid siiski veenvalt, et tegemist on tropülium(tsükloheptatrieeniumi)bromiidiga. See ioon on Hückeli reegli järgi ennustatavalt aromaatne.
1902. aastal avastasid Norris ja Kehrman sõltumatult, et värvitu trifenüülmetanool annab kontsentreeritud väävelhappes sügavkollaseid lahuseid. Trifenüülmetüülkloriid moodustas sarnaselt alumiinium- ja tinakloriididega oranžid kompleksid. 1902. aastal tunnistas Adolf von Baeyer moodustatud ühendite soolalaadset iseloomu.
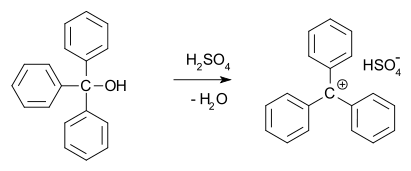
Ta nimetas värvi ja soola moodustumise vahelist seost halokroomiks, mille parim näide on malahhiidi roheline.
Karbokatsioonid on paljude orgaaniliste reaktsioonide reaktiivsed vaheproduktid. Seda ideed, mille esmakordselt pakkus välja Julius Stieglitz 1899. aastal, arendas edasi Hans Meerwein oma 1922. aasta uurimuses Wagner-Meerweini ümberpaigutamise kohta. Samuti leiti, et karbokatsioonid osalevad NS1-reaktsioonis, E1-reaktsioonis ja ümberpaiknemisreaktsioonides, nagu Whitmore'i 1,2-nihkumine. Keemiainstitutsioon ei tahtnud karbokatsiooni mõistet aktsepteerida ja pikka aega keeldus ajakiri Journal of the American Chemical Society neid mainivatest artiklitest.
Esimese stabiilse karbokatsiooni NMR-spektri lahuses avaldasid Doering et al. 1958. aastal. Tegemist oli heptametüülbenseeniooniga, mida valmistati heksametüülbenseeni töötlemisel metüülkloriidi ja alumiiniumkloriidiga. Stabiilne 7-norbornadienüülkatsioon valmistati Story et al. poolt 1960. aastal norbornadienüülkloriidi reageerimisel hõbetetrafluoroboraadiga vääveldioksiidis -80 °C juures. NMR-spektri järgi oli see mitteklassiliselt sildunud (esimene täheldatud stabiilne mitteklassiline ioon).
1962. aastal täheldas Olah otseselt tert-butüülkarbokatsiooni kui stabiilset liiki tert-butüülfluoriidi lahustamisel maagilises happes tuumamagnetresonantsi abil. Norbornüülkatsiooni NMR-test teatasid esmakordselt Schleyer et al. ja Saunders et al. näitasid, et see läbib prootonite särisemist üle barjääri.
Omadused
Orgaanilises keemias on karbokatioon sageli nukleofiilse rünnaku sihtmärk nukleofiilide, näiteks hüdroksüül- (OH-−) ioonide või halogeeniioonide poolt.
Karbokatsioonid liigitatakse primaarseteks, sekundaarseteks või tertsiaarseteks sõltuvalt ioniseeritud süsiniku aatomite arvust. Primaarsetel karbokatioonidel on ioniseeritud süsiniku külge seotud üks või null süsinikku, sekundaarsetel karbokatioonidel on ioniseeritud süsiniku külge seotud kaks süsinikku ja tertsiaarsetel karbokatioonidel on ioniseeritud süsiniku külge seotud kolm süsinikku.
Karbokatsiooni stabiilsus suureneb koos laengut kandva süsinikuga seotud alküülrühmade arvuga. Tertsiaarsed karbokatsioonid on stabiilsemad (ja moodustuvad kergemini) kui sekundaarsed karbokatsioonid; primaarsed karbokatsioonid on väga ebastabiilsed, sest kui ioniseeritud kõrgema astme süsinikud on stabiliseeritud hüperkonjugatsiooni teel, siis asendamata (primaarsed) süsinikud mitte. Seetõttu ei toimu tavaliselt selliseid reaktsioone nagu NS1-reaktsioon ja E1 eliminatsioonireaktsioon, kui moodustuks primaarne karbokatioon. Erandiks on see, kui ioniseeritud süsiniku kõrval on süsinik-süsiniku kaksikside. Sellised katioonid nagu allüülkatsioon CH=CH-CH22+ ja bensüülkatsioon6 CH-CH52+ on stabiilsemad kui enamik teisi karbokatioone. Molekulid, mis võivad moodustada allüül- või bensüülkarbokatsioone, on eriti reaktiivsed.
Karbokatsioonid läbivad ümberkorraldusreaktsioone vähem stabiilsetest struktuuridest sama stabiilseteks või stabiilsemateks struktuurideks kiiruskonstandiga üle 10/sek9. See asjaolu raskendab paljude ühendite sünteesimise võimalusi. Näiteks kui 3-pentanooli kuumutatakse vesilahuse HCl-ga, siis algselt moodustatud 3-pentüülkarbokatsioon paigutub ümber 3-pentüüli ja 2-pentüüli statistiliseks seguks. Need katioonid reageerivad kloriidiooniga, tekitades umbes 1/3 3-kloropentaani ja 2/3 2-kloropentaani.
Mõned karbokatioonid, näiteks norbornylkatsioon, on enam-vähem sümmeetrilise kolmekeskuselise sidemega. Selliseid katioone on nimetatud mitteklassilisteks ioonideks. Energiavahe "klassikaliste" karbokatioonide ja "mitteklassiliste" isomeeride vahel on sageli väga väike ning "klassikaliste" ja "mitteklassiliste" struktuuride vahelisel üleminekul on üldiselt vähe või üldse mitte mingit aktiveerimisenergiat. 2-butüülkarbokatsiooni "mitteklassiline" vorm on sisuliselt 2-buteen, mille prooton asub otse süsinik-süsiniku kaksiksideme keskme kohal. "Mitteklassilised" karbokatsioonid olid kunagi suure vaidluse objektiks. Üks George Olahi suurimaid panuseid keemiale oli selle vaidluse lahendamine.
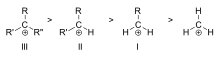
Tertsiaarsete (III), sekundaarsete (II) ja primaarsete (I) alküülkarbokatsioonide stabiilsuse järjekord
Spetsiifilised karbokatsioonid
Tsüklopropüülkarbinüülkatsioonide uurimine on võimalik NMR-meetodil:
Dimetüülderivaadi NMR-spektris on leitud kaks mittekvivalentset signaali kahe metüülrühma kohta, mis näitab, et selle katiooni molekulaarkonformatsioon ei ole risti (nagu A-s), vaid on poolitatud (nagu B-s), kusjuures tühi p-orbitaal ja tsüklopropüülrõngassüsteem asuvad samas tasapinnas:
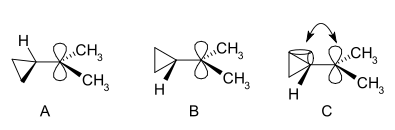
Painutatud sidemete teooria seisukohalt on see eelistus seletatav sellega, et täidetud tsüklopropaani painutatud sidemete ja tühja p-orbitaali vahel on soodne orbitaalide kattumine.
Küsimused ja vastused
K: Mis on karbokatioon?
V: Karbokatsioon on ioon, millel on positiivselt laetud süsiniku aatom.
K: Milline on karbokatiooni väline valentsuskoor?
V: Karbokatsiooni välisvalentsuskoorel on stabiilsete kaheksa valentsuselektroni asemel ainult kuus elektroni.
K: Miks on karbokatioonid sageli reaktiivsed?
V: Karbokatsioonid on sageli reaktiivsed, sest nad püüavad täita valentselektronide kaheksandikku ning taastada neutraalse laengu.
K: Milline on süsiniku aatomite maksimaalne stabiilsus?
V: Süsinikuaatomite maksimaalne stabiilsus saavutatakse siis, kui neil on kaheksa valentselektroni.
K: Mis on keemias kuuendik?
V: Sextett on termin, mida kasutatakse karbokatsiooni süsinikuaatomi kirjeldamiseks, mille välisvalentsuskoores on stabiilsete kaheksa valentselektroni asemel ainult kuus elektroni.
K: Milline on karbokatsiooni hübriidsus ja molekulaargeomeetria?
V: Kuigi loogika kohaselt oleks karbokatioonidel sp3-hübriidsus koos tühja sp3-orbitaaliga, mis annab positiivse laengu, sarnaneb nende reaktsioonivõime pigem sp2-hübriidsusele trigonaalse planaarse molekulaargeomeetriaga.
K: Mis on okteti reegel?
V: Okteti reegel on keemias kehtiv põhimõte, mille kohaselt kipuvad aatomid moodustama teiste aatomitega keemilisi sidemeid, mis võimaldavad mõlemal aatomil omada stabiilset kaheksast valentselektronist koosnevat komplekti.
Otsige