Termodünaamika teine seadus: entroopia, soojuse vool ja piirangud
Termodünaamika teine seadus: selgitus entroopia kasvust, soojuse voolust ja praktilistest piirangutest — lihtne ja põhjalik ülevaade Clausiuse ja Kelvini põhimõtetest.
Termodünaamika teine seadus ütleb, et kui energia muutub ühest vormist teise või aine liigub vabalt, suureneb suletud süsteemis entroopia (korrastamatus). See tähendab praktiliselt, et suletud (isoleeritud) süsteemis toimuvad protsessid kulgevad selliselt, et üldine järjestus väheneb ja juhuslikkus suureneb — süsteemi mikrostaatide arv, mis vastab makrostaatile, kipub aja jooksul kasvama.
Temperatuuri, rõhu ja tiheduse erinevused kipuvad mõne aja pärast horisontaalselt tasanduma. Gravitatsioonijõu tõttu ei tasandu tihedus ja rõhk vertikaalselt: tihedus ja rõhk on allpool suuremad kui ülevalpool. See on näide sellest, et termodünaamilised tasakaalutingimused sõltuvad ka välistest jõududest ja piirtingimustest.
Mis on entroopia?
Entroopia on energia ja aine leviku mõõt — laiemal, statistilisel tasandil öeldes on see makrostaatile vastavate mikrostaatide arvu logaritm. Boltzmanni valemina: S = k ln Ω, kus S on entroopia, k on Boltzmanni konstant ja Ω on võimalike mikrostaatide arv. Entroopia kui olekufunktsiooni muutus seostub ka soojusvahetusega: diferentiaalvormis kehtib kadudeta (reversiivse) protsessi puhul dS = δQ_rev / T.
Clausius’i ja Kelvini sõnastused
Termodünaamika teise seaduse tuntuim sõnastus pärineb Rudolf Clausiusest ja seda võib väljendada mitmel ekvivalentsel moel. Originaaltekstist lähtuv lihtsustav väide on, et soojus ei lähe iseenesest külmemast kehast kuumemasse.
Soojus ei saa iseenesest liikuda külmemast kehast kuumemasse.
Lord Kelvini samaväärne avaldus on järgnev:
Ümberkujundamine, mille ainus lõpptulemus on konstantsel temperatuuril allikast võetud soojuse muundamine tööks, on võimatu.
Need kaks väidet (Clausius ja Kelvin–Planck) on formaalselt ekvivalentsed: mõlemad piiravad soojuse ja töö vahelisi pööratavaid teisendusi ning seavad piirid soojusmootorite (näiteks Carnot’ masina) efektiivsusele. Carnot' teoreemi järgi on kõrgeima võimalik efektiivsuse piiriline väärtus kahe termilise reservuaari vahel: η_max = 1 − T_külm / T_soe (temperatuurid absoluutväärtustes).
Matemaatiline ja statistiline tõlgendus
Isolatsioonitingimustes kehtib lihtne ja oluline seos:
- dS_tot ≥ 0 — kogu (süsteemi + keskkonna) entroopia ei lange (võrdus 0 ainult ideaalselt reversiivsete protsesside korral);
- dS = δQ_rev / T — entroopia muutus pööratavas protsessis.
Statistilisest vaatenurgast on teine seadus tõenäosuslik: makroskoopses süsteemis domineerivad mikrostaatid, mis annavad suurema Ω, seega on selliste makrostaatide esinemine tõenäolisem. Väikestes süsteemides võivad tekkida ajutised entroopiale vastupidised kõikumised (joskus nimetatakse neid Fluktuatsiooniteoreemide mõjul), kuid suure hulga osakeste korral on mõju ebaoluline ja teine seadus praktiliselt täiuslik.
Praktilised tagajärjed ja näited
Teisest seadusest tulenevad mitmed tuntud nähtused ja piirangud:
- Soojuse loomulik vool on soojemalt külmemale; selle tõttu ei toimi soojusmootorid 100% efektiivsusega.
- Segunemine (näiteks kaks erineva soojusega veeportsjonit segunevad) on pöördumatu ilma välise töö tegemiseta — entroopia suureneb.
- Elusüsteemid võivad lokaalselt entroopiat vähendada (näiteks teha korda ja ehitada keerukaid struktuure), kuid see nõuab energiat ja põhjustab suurema entroopia kasvu keskkonnas — teine seadus jääb kehtima kogusüsteemi tasandil.
Piirangud ja erandlikud mõisted
Oluline on meeles pidada, et teine seadus kehtib selgelt ja vahetult suurtele, makroskoopilistele ja mitte-kvantmehaanilistele süsteemidele ning käsitleb tõenäolist käitumist. See ei ole absoluutne keel seoses üksikute mikroskoopiliste sündmustega — kvant- ja statistilises füüsikas võivad olla lühiajalised fluktuatsioonid, kus entroopia väheneb, kuid need on ebatõenäolised suures skaalas. Samuti ei tähenda teine seadus, et mingit konkreetset lokaalset entroopia vähendamist ei saa saavutada: seda saab, kuid hinnaks on suurem entroopia kasv mujal (näiteks soojuse eraldumine).
Läheduses olevad teemad
Teise seaduse käsitluses on tihedalt seotud teemad nagu töö ja soojuse vahe, Carnot-tsüklid, irreversiivsus, informatsiooniteooria seosed (näiteks Maxwelli deemon ja Landaueri printsiip, mis näitab informatsiooni töötlemise entroopilist kulu) ning statistiline mehaanikaga tuletatud entroopia mõiste. Kõik need laiendavad arusaama sellest, miks protsessid kulgevad teatud suunas ja millised on praktilised piirid energia muundamisele.
Teine seadus ei ole ainult abstraktne printsiip: see määrab paljude tehnoloogiate (soojusmootorid, külmutusseadmed, elektrijaamad) piirid ning seletab, miks aja jooksul süsteemid püsivalt kipuvad jõudma tasakaaluolekusse, kus temperatuuri- ja rõhuerinevused on likvideeritud või püsivad ainult väliste jõudude (nt gravitatsiooni) mõjul.
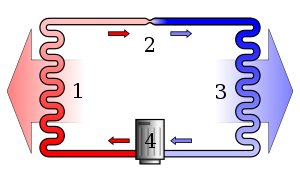
Soojuspumba aurukompressiooniga jahutustsükli lihtne stiliseeritud skeem: 1) kondensaator, 2) paisumisventiil, 3) aurusti, 4) kompressor.
Ülevaade
Üldises mõttes ütleb teine seadus, et temperatuurierinevused omavahel kokkupuutuvate süsteemide vahel kipuvad tasanduma ja et nendest mitte-tasakaalulistest erinevustest saab tööd, kuid töö tegemisel ja entroopia suurenemisel tekib soojusenergia kadu. Rõhu, tiheduse ja temperatuuri erinevused isoleeritud süsteemis kipuvad kõik tasanduma, kui selleks on võimalus; tihedust ja rõhku, kuid mitte temperatuuri, mõjutab gravitatsioon. Soojusmootor on mehaaniline seade, mis annab kasuliku töö kahe keha temperatuurierinevusest.
Tsitaadid
| “ | Seadus, et entroopia suureneb alati, on minu arvates loodusseaduste seas ülimalt tähtis. Kui keegi osutab teile, et teie lemmikteooria universumi kohta ei ole kooskõlas Maxwelli võrranditega - siis seda hullem on Maxwelli võrrandid. Kui aga avastatakse, et see on vastuolus vaatlustega - noh, need eksperimentaatorid teevad mõnikord viga. Aga kui teie teooria osutub vastuolus olevaks termodünaamika teise seadusega, siis ei saa ma teile mingit lootust anda; ei jää muud üle, kui sügavas alanduses kokku variseda. | ” |
--Sir Arthur Stanley Eddington, Füüsikalise maailma olemus (1927)
| “ | Entroopia suurenemise tendentsi isoleeritud süsteemides väljendab termodünaamika teine seadus - ehk kõige pessimistlikum ja amoraalsem formuleering kogu inimliku mõtteviisi jooksul. | ” |
--Greg Hill ja Kerry Thornley, Principia Discordia (1965)
| “ | Teise seaduse sõnastusi on peaaegu sama palju, kui on olnud arutelusid selle üle. | ” |
--filosoof/füüsik P.W. Bridgman, (1941)
Muu
- Flanders ja Swann esitasid termodünaamika teise seaduse avalduse muusikasse, mis kannab pealkirja "Esimene ja teine seadus.
- Majandusteadlane Nicholas Georgescu-Roegen näitas entroopia seaduse tähtsust majandusteaduses (vt tema teos The Entropy Law and the Economic Process (1971), Harvard University Press).
Küsimused ja vastused
K: Mis on termodünaamika teine seadus?
V: Termodünaamika teine seadus sätestab, et kui energia muutub ühest vormist teise või aine liigub vabalt, suureneb suletud süsteemis entroopia (korrastamatus).
K: Mis kipub aja jooksul horisontaalselt tasanduma?
V: Temperatuuri, rõhu ja tiheduse erinevused kipuvad mõne aja pärast horisontaalselt tasanduma.
K: Miks ei tasandu tihedus ja rõhk vertikaalselt?
V: Gravitatsioonijõu tõttu ei tasandu tihedus ja rõhk vertikaalselt. Tiheus ja rõhk on altpoolt suurem kui ülaltpoolt.
K: Mis on entroopia?
V: Entroopia on aine ja energia leviku mõõtmine kõikjale, kuhu neil on juurdepääs.
K: Milline on termodünaamika teise seaduse kõige tavalisem sõnastus?
V: Termodünaamika teise seaduse kõige tavalisem sõnastus tuleneb sisuliselt Rudolf Clausiusest: kõik püüab aja jooksul säilitada sama temperatuuri.
K: Milline on veel üks Clausiuse väide termodünaamika teise seaduse kohta?
V: Teine Clausiuse väide on, et soojus ei saa iseenesest minna külmemast kehast kuumemasse.
K: Millise süsteemi suhtes kehtib termodünaamika teine seadus?
V: Termodünaamika teine seadus kehtib ainult suurte süsteemide suhtes, kus energiat või ainet ei pääse sisse ega välja. Mida suurem on süsteem, seda tõenäolisemalt kehtib teine seadus.
Otsige