Tioketoon (tioon): definitsioon, omadused ja reaktsioonid
Ülevaade tioketoonidest (tioon): struktuur, omadused, kõrge reaktiivsus ja tüüpilised reaktsioonid — teooria, näited ja roll orgaanilises sünteesis.
Tioketoon (või tioon) on mis tahes molekul, mille rühm R2C=S. See on sarnane tavalisele ketoonile, kuid hapniku aatom on asendunud väävli aatomiga. Väävli aatomil on süsinikuaatomiga kaksikside (C=S) ja lisaks säilitab see kaks üksikpaari. Tioketoonide elektroniline struktuur ja orbitaalide paigutus erinevad ketoonidest: väävel on vähem elektronegatiivne kui hapnik ja selle suuram aatomiraadius muudab C=S-side polarisatsiooni ja reaktiivsust.
Struktuur ja omadused
- Side ja resonants: C=S kaksikside sisaldab σ- ja π-komponente, kuid π-side on tavaliselt nõrgem ja vähem delokaliseeritud kui C=O puhul. See muudab elektrofiilseks süsinikku C=S-lagunemispunktis.
- Taski- ja reaktiivsuse erinevus ketoonidega: väävli madalam elektronegatiivsus annab tioketoonidele suurema polariseerituse ja sageli kõrgema reaktiivsuse võrreldes ketoonidega; C=S on parem elektrofiil kui C=O.
- Värvus: paljud tioketoonid on intensiivse värvusega (kollased kuni lillakad), sest nende n→π* ja π→π* üleminekud paiknevad nähtavas piirkonnas.
- Tautomeerid: tioketoonid võivad teoreetiliselt eksisteerida enethioli (thioenoolide) vormis, kuid tavaliselt on tioon tuvastatav kui peamine vorm; enethioli-tautomeerid on sageli vähem levinud.
Süntees
- Thioneerimine (thionation): tioketoonid saadakse tihti tuntud reagendiga nagu Lawesson’i reagent, fosforpentasulfid (P4S10) või Woollins’i reagent, mis asendavad süsinikyliselt seotud hapniku väävliga.
- Spetsiifilised lähenemised: mõnikord valmistatakse neid ka liitmikute või oksükarbonyli derivaadist redutseerimise ja edasise modifikatsiooni teel. Mõned aromaatsed tioketoonid saab otse sünteesida sobiva prekursori oksüdeerimise/järeltöötlusega.
Reaktsioonid ja reaktiivsus
Tioketoonid on sageli väga reaktiivsed ja paljud neist on ebastabiilsed. Nende reaktiivsus tuleneb peamiselt heast elektrofiilsusest süsiniku suhtes ja väävli suuremast aatomiraadiusest.
- Nukleofiilne addition: nagu ketoonid, undergoerivad tioketoonid nukleofiilset lisandumist, ent sageli kiiremalt ja teistsuguste reaktsiooniteedega.
- Tsüklilisatsioonid ja dimerisatsioon: paljud tioketoonid kalduvad moodustama rõngaid või dimeriseeruma. Nad osalevad tsükli‑liitumisreaktsioonides, mis sarnanevad Diels-Alderi reaktsioonile (näiteks [4+2]-tsükloliitumised dienidega), ning annavad sageli väävlisisaldusega tsüklilisi tooteid.
- Tiiaalid (thialid): kui üks R-rühmadest on vesinik, on molekul aldehüüdi väävliversioon ehk tiiaal. Tiiaalid on veelgi reaktiivsemad kui tioketoonid ja kipuvad kiiresti polümeriseeruma või osalema lisandreaktsioonides.
- Muud reaktsioonid: tioketoonid võivad osaleda redutseerimisel (nt viimistlus tioli või tioala tootmiseks), saada osaks metalli‑organilistest katalüütilistest protsessidest ning olla lähteaineteks tioketaalide (thioketals) või muude väävlijääkidega ühendite moodustamiseks.
Spektroskoopia ja iseloomustavad tunnused
- IR-spektroskoopia: C=S-võnkumised asuvad tavaliselt madalama sagedusvahemikus kui C=O; sageli jääb neid signaalid alla 1200 cm−1 (sõltuvalt ainese struktuurist ja konjugatsioonist).
- NMR: tioketooni karbonüüli süsinik annab 13C-NMR‑is sageli äärmiselt ala‑ või ülaldesoksrebitud signaali (sarnases piirkonnas nagu karbonüülsüsinikud, kuid sõltuvalt sidepinge ja konjugatsiooniastmest võivad väärtused varieeruda).
- UV‑Vis: paljud tioketoonid näitavad tugevaid rünnakuid nähtavas piirkonnas, mis seletab nende intensiivset värvi.
Näited ja rakendused
- Stabiilsemad aromaatsed tioketoonid (nt fenüültioonid) on uurimisobjektid orgaanilises sünteesis ja katalüütilistes protsessides.
- Tioketone kasutatakse vahel lähteainetena komplekssete väävlisisaldusega ühendite moodustamiseks ning orgaaniliste materjalide ja pigmentide sünteesis tänu nende värviprofiilile ja kõrgele reaktiivsusele.
Ohutus ja käitlemine
- Paljud tioketoonid on keemiliselt aktiivsed, võivad olla toksilised või ebameeldiva lõhnaga ning mõnel juhul kergesti polümeriseeruvad. Töötamisel kasutage sobivaid kaitsevahendeid ja inertset atmosfääri vastavalt vajadusele.
- Spetsiifilise ühendi ohtlikkuse hindamiseks tuleb vaadata selle ohutuskaart (SDS) ja järgivõtta laborikaitse nõudeid.
Kokkuvõtlikult on tioketoonid väävliga asendatud ketoonid, mille kaksikside C=S ja väävli omadused annavad neile suure reaktiivsuse ja eripärase keemilise käitumise — nad on head elektrofiilid, tihti ebastabiilsed ning kalduvad moodustama rõngaid ja osalema tsükliliitumistes sarnanedes Diels-Alderi- tüüpi protsessidele.
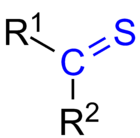
Tioketooni üldine struktuur
Küsimused ja vastused
K: Mis on tioketoon?
V: Tioketoon on mis tahes molekul, mille rühm R2C=S on nagu ketoon, mille hapniku aatom on vahetatud väävli aatomi vastu.
K: Kuidas on väävliaatom seotud süsinikuaatomiga tioketoonis?
V: Väävli aatomil on süsiniku aatomiga kaksikside.
K: Miks on tioketoonid väga reaktiivsed?
V: Tioketoonid on väga reaktiivsed, sest nad on head elektrofiilid.
K: Mis juhtub, kui tioketoonid tahavad moodustada rõngaid?
V: Kui tioketoonid tahavad moodustada rõngaid, teevad nad seda tsüklilisatsioonireaktsioonide abil, mis sarnaneb Diels-Alderi reaktsioonile.
K: Mis on tiakioonid?
V: Tiial on aldehüüdi väävliversioon. See on molekul, mille R2C=S ja üks R-rühmadest on vesinik.
K: Kuidas on tiali reaktiivsus võrreldav tioketooni omaga?
V: Tiial on veelgi reaktiivsem kui tioketoon.
K: Kas tioketoonid ja tiialid on stabiilsed molekulid?
V: Paljud tioketoonid on ebastabiilsed molekulid, samas kui tiialid on isegi reaktiivsemad kui tioketoonid.
Otsige