Aldehüüdid (R-CHO): definitsioon, struktuur ja kasutus
Aldehüüdid (R‑CHO): selge definitsioon, molekulaarne struktuur ja praktilised kasutused — lõhnaained, süntees ja tööstuslikud rakendused orgaanilises keemias.
Aldehüüd (/ˈældɪhaɪd/) on orgaaniline ühend. See sisaldab formüülrühma. Formüülrühm on molekuli osa, mille struktuur on R-CHO. See koosneb hapnikuga kahekordselt seotud süsinikust. Hapnik on seotud ka vesiniku ja R-rühmaga. Külgrühm on molekuli ülejäänud osa. Ilma külgrühmata rühma nimetatakse aldehüüdrühmaks või formüülrühmaks. Aldehüüdid erinevad ketoonidest, sest formüülrühm on aldehüüdil molekuli lõpus, ketoonidel aga molekuli keskel. Aldehüüdid on orgaanilises keemias laialdaselt levinud ja paljud lõhnaained on aldehüüdid.
Struktuur ja nimetus
Aldehüüdide üldvalem on R–CHO, kus R võib olla vesinik (H) või orgaaniline asendaja (alküüli- või arüülrühm). Kui R = H, nimetatakse ühendeid formaldehüüdideks (näiteks metanaal). Tuntud näited:
- Metanaal (formaldehüüd) — HCHO
- Etanaal (atsetaldehüüd) — CH3CHO
- Bensaldehüüd — C6H5CHO
Füüsikalised omadused
- Aldehüüdid on tavaliselt polaarsemad kui lihtsad süsivesinikud ja neil on kõrgem sulam- ja keemistemperatuur kui analoogsed mittepolaarsete ühendite puhul, kuid madalam kui vastavatel alkoholidel, kuna aldehüüdid ei loo tugevaid vesiniksidemeid omavahel.
- Põhivaatlused: madalama molekulmassiga aldehüüdid on gaasilised või väga lenduvad vedelikud; suuremad aldehüüdid on vedelikud või tahked ained.
- Paljud aldehüüdid on hästi lõhnavad ning neid kasutatakse lõhna- ja maitseainetes (nt muskuse või lillelõhna noodid).
Keemiline reaktiivsus
Aldehüüdide reaktsioonid põhinevad süsiniku ja hapniku vahelisel polaarsemaast karbonüüli (C=O) keemilisest iseloomust ning terminalse süsiniku suuremast elektropositiivsusest (H kõrval). Olulised reaktsioonid:
- Nukleofiilne additsioon — aldehüüdid reageerivad nukleofiilidega (nt alkoholid, amiinid, CN–, H–), moodustades vastavalt hemiacetale, happe- või aluselisi addukte. See on aldehüüdide tüüpiline reaktsioon.
- Lindude (reduktiivsed) reaktsioonid — aldehüüdid redukteeritakse hõlpsasti primaarseteks alkoholideks (redutsendid: NaBH4, LiAlH4 või H2/Pd).
- Oxüdatsioon — aldehüüdid oksüdeeruvad kergesti karboksüülhapeteks (nt KMnO4, H2O2, Ag2O). See eristab neid ketoonidest ja kasutatakse reageerimismärkide (Tollensi ja Fehlingi teste) alusel.
- Kondensatsioonid — aldoolkondensatsioon (kaht aldehüüdi või aldehüüdi ja ketooni vahel) võimaldab α,β-ühenduse teket; Cannizzaro-reaktsioon toimub ilma α-vesinikuta aldehüüdidel (üsna tugevates aluslahustes), kus osa molekulidest oksüdeerub ja osa redukteerub, andes karboksülaadi ja alkoholi.
- Tollensi ja Fehlingi testid — aldehüüdide tunnused: Tollensi katse annab „hõbedapeegli” ja Fehlingi lahus värvimuutuse kuivaalusel; need testid kasutavad aldehüüdide kergesti oksüdeeritavat olemust.
Süntees ja valmistusviisid
- Primaarsete alkohoolide õige oksüdeerimine annab aldehüüde (nt PCC, kontrollitud oksüdatsioon). Liigne oksüdatsioon annab aga karboksühappe.
- Araak- ja funktsionaalvahetusmeetodid: Rosenmundi reduktsioon (atsüülklooriid → aldehüüd), Gattermanni–Koch süntesis arüülaldehüüdide saamiseks ning ozonolüüs alkeenidest, mis võib anda aldehüüde (sõltuvalt tingimustest).
- Kommertsiaalselt toodetakse aldehüüde ka oksüdatiivse dehüdrogenatsiooni ja muude tööstuslike protsesside kaudu.
Kasutusvaldkonnad
- Lõhna- ja maitseained: mitmed aldehüüdid annavad iseloomulikke lõhnu (nt viraalne või lilleline aroom) ja kasutatakse parfümeerias ning maitseainetööstuses.
- Keemiatööstus: aldehüüdid on tähtsad sünteesi alustalad mitmete orgaaniliste ühendite (polümeeride, vaheühendite, farmaatseutikumide) valmistamisel.
- Tööstuslikud materjalid: formaliinhapete derivaate ja formaldehüüdi vaigud, fenoolformaldehüüdi vaigud on ehitus- ja liimimistööstuses laialt kasutusel.
Ohutus ja tervisemõjud
Mõned aldehüüdid (eriti formaldehüüd) on toksilised ja ärritavad: silmade, nina ja hingamisteede ärritus, pikem kokkupuude võib olla kantserogeenne. Tööstuslikes tingimustes tuleb kasutada asjakohaseid kaitsemeetmeid (ventilatsioon, isikukaitsevahendid) ning järgida ohutusjuhiseid. Aldehüüdid võivad ka polümeriseeruda või reageerida mittesoovitud viisil, seetõttu säilitatakse ja käideldakse neid ettevaatlikult.
Spektroskoopilised tunnused
- IR-spektroskoopias annab karbonüülne C=O venitus tugev piik tavaliselt ~1720–1740 cm–1 (konjugatsiooni või molekulaarse struktuuri tõttu võib nihkeid esineda).
- NMR-is ilmneb aldehüüdi prooton (–CHO) tavaliselt 9–10 ppm piirkonnas 1H NMR-s.
Kokkuvõtvalt on aldehüüdid orgaanilise keemia oluline klass: nende iseloomulik terminalne formüülrühm määrab kõrge reaktiivsuse, mis teeb neist väärtuslikud sünteesivahendid, lõhna- ja maitseainete koostisosad ning tööstuslikud lähteained — samas nõuavad nad ettevaatlikku käitlemist terviseriskide tõttu.
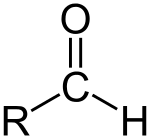
Aldehüüd.
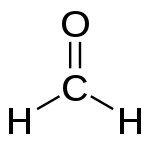
Formaldehüüd, mis on lihtsaim aldehüüd.
Struktuur ja sidumine
Aldehüüdidel on süsinik kahekordselt seotud hapnikuga. Seetõttu on nad kergelt polaarsed. Selle tõttu on aldehüüdidel mitmeid omadusi. Üks tähtsamaid neist on lahustuvus vees.
Nomenklatuur
Aldehüüdide IUPACi nimed
Aldehüüdide üldnimetused ei ole alati ametlikud nimetused. IUPACi nimed on siiski kasulikud. IUPAC soovitab aldehüüdide jaoks järgmist nomenklatuuri:
- Aldehüüdid, millel ei ole süsinikuringe, nimetatakse pikima aldehüüdi sisaldava süsinikuahela järgi. Seega nimetatakse HCHO metaani alusel ja CH3CH2CH2CHO butaani alusel. Nimi moodustub, kui muuta algse alkaani lõpp -e -al-iks. HCHO nimetatakse metanaaliks. CH3CH2CH2CHO nimetatakse butaaniks.
- Kui rõngale on lisatud -CHO-rühm, siis lisatakse nime lõppu -karbaldehüüd. Seetõttu nimetatakse C6H11CHO tsükloheksaankarbaldehüüdiks. Kui sõna lõppu on vaja lisada muid nimetusi, sest seal on ka teisi funktsionaalseid rühmi, lisatakse sõna algusesse formüül-. Mõnikord lisatakse selle asemel metanoüül, kuid formüül- on parem.
Etümoloogia
Sõna aldehüüd pärineb ladina keelest. See on lühendatud sõnast alcohol dehydrogenatus (dehüdrogeenitud alkohol). Sõna aldehüüdi lõi Justus von Liebig. Varem nimetati aldehüüde mõnikord vastavate alkoholide järgi, näiteks veinialdehüüdi puhul atseetaldehüüdi. (Vinous tuleneb ladinakeelsest sõnast vein, mis on traditsiooniline etanooli allikas).
Termin formüülrühm tuleneb ladinakeelsest või itaalia sõnast formica, mis tähendab sipelga.
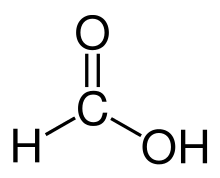
Sipelghape
Füüsikalised omadused ja iseloomustus
Aldehüüdidel on palju erinevaid omadusi. Need omadused muutuvad palju, kui ülejäänud molekul muutub. Väiksemad aldehüüdid on vees paremini lahustuvad. Formaldehüüd ja atseetaldehüüd lahustuvad vees täielikult. Paljudel aldehüüdidel on tugev lõhn. Aldehüüdid lagunevad õhus.
Kaks kõige olulisemat aldehüüdi, formaldehüüd ja atseetaldehüüd, kipuvad moodustama pikki ahelaid. Seda nimetatakse polümerisatsiooniks.
Looduslikult esinevad aldehüüdid
Eeterlikes õlides leidub palju aldehüüde, mis on nende lõhna põhjuseks. Kaneelaldehüüd, koriander ja vanilliin saavad oma lõhna aldehüüdidest.
Üldised reaktsioonid
Aldehüüdid on väga reaktiivsed ja osalevad paljudes reaktsioonides." Tööstuses kasutatakse aldehüüde plastifikaatorite, polüoolide ja alkoholide valmistamiseks. Bioloogias kasutatakse aldehüüde aminirühmade asendamiseks ja suhkrute moodustamiseks.
Dialdehüüdid
Dialdehüüd on molekul, milles on kaks aldehüüdi. Dialdehüüdide nimedes on lõpp -dial või -dialdehüüd. Mõned dialdehüüdid on nimetatud happe järgi, millega nad on sarnased. Näiteks on butanedial, mida nimetatakse ka suktsinaldehüüdiks (merevaikhappest).
Aldehüüdide näited
- Metanaal (formaldehüüd)
- etanool (atseetaldehüüd)
- Propanal (propionaldehüüd)
- Butanaal (butüüraldehüüd)
- Bensaldehüüd
- Cinnamaldehyde
- Tolualdehüüd
- Furfuraal
- Retinaldehüüd
Dialdehüüdid
- Glyoxal
- Malondialdehüüd
- Succindialdehyde
- Glutaraldehüüd
- Ftaldehüüd
Kasutab
Kõikidest aldehüüdidest tekib kõige rohkem formaldehüüdi. Aastas toodetakse umbes 6 miljonit tonni. Seda kasutatakse peamiselt vaikude valmistamiseks, kui seda segatakse karbamiidi, melamiini ja fenooliga. Bakeliiti valmistatakse niimoodi. Teine sageli valmistatud aldehüüd on butüraldehüüd. Aastas toodetakse 2 ja pool miljonit tonni. Kunagi tehti palju atseetaldehüüdi, kuid tänapäeval tehakse seda palju vähem. See on tingitud sellest, et kemikaale, mida varem valmistati atseetaldehüüdist, valmistatakse nüüd teistmoodi.
Seotud leheküljed
Küsimused ja vastused
K: Mis on aldehüüd?
V: Aldehüüd on orgaaniline ühend, mis sisaldab formüülrühma.
K: Mis on formüülrühm?
V: Formüülrühm on molekuli osa, mille struktuur on R-CHO, mis koosneb hapnikuga kaksiksidemetega seotud süsinikust, mis on samuti seotud vesinikuga ja R-rühmaga.
K: Mis on molekuli külgahel?
V: Külgahel on molekuli ülejäänud osa, välja arvatud funktsionaalne rühm.
K: Mis on funktsionaalne rühm aldehüüdis?
V: Funktsionaalne rühm aldehüüdis on aldehüüdrühm või formüülrühm.
K: Mille poolest aldehüüdid erinevad ketoonidest?
V: Aldehüüdides asub formüülrühm molekuli lõpus, ketoonides aga keskel.
K: Milline on aldehüüdide tähtsus orgaanilises keemias?
V: Aldehüüdid on orgaanilises keemias levinud ja neid kasutatakse paljudes reaktsioonides reaktantide või vaheproduktidena.
K: Millised on mõned aldehüüdide tavalised kasutusalad?
V: Paljud lõhnaained, näiteks Chanel No. 5, koosnevad aldehüüdidest. Seda võib kasutada toiduainetes säilitusainetena. Neid kasutatakse ravimite, värvainete ja muude kemikaalide tootmisel vahesaadustena.
Otsige