Mis on aatomi orbitaal? Määratlus, tüübid ja roll kvantmehaanikas
Aatomi orbitaalid: selge määratlus, s/p/d/f tüübid, elektrooniline paigutus ja orbitaalide roll kvantmehaanikas — põhjalik ja arusaadav juhend nii algajale kui edasijõudnule.
Aatomi orbitaalid on aatomi tuuma ümber paiknevad kvantmehaanilised piirkonnad, kus üksikute elektronide või elektronipaaride leidmise tõenäosus on suurim. Orbitaal ei ole klassikaline orbiit, vaid see tuleneb matemaatilisest funktsioonist — lainefunktsioonist ψ — mis kirjeldab elektroni lainelist käitumist aatomis ning mille ruut (|ψ|2) annab tõenäosustiheduse ehk elektroni leidmise tõenäosuse teatud piirkonnas.
Ajaloone ja terminoloogia
Sõna „orbitaalne“ tekkis ajal, mil elektronide liikumist võrreldi päikesesüsteemi mudeliga: tuum nagu päike ja elektronid tiirlevad nagu planeedid. See klassikaline pilt on lihtsustatud; kvantmehaanika näitab, et elektronite käitumine on laineline ja statistiline, mitte kindel trajektoor.
Kuidas orbitaalid kirjeldatakse
Iga orbitaali määravad neli kvantarvu: peamine kvantarv n (tugev energia- ja radiaalne sõltuvus), azimutal-või orbitaalne kvantarv l (kujule viitav), magnetkvantarv ml (orientatsioon ruumis) ja spinniväärtus ms (elektroni spin). Iga orbitaal võib olla hõivatud maksimaalselt kahe elektroniga, mille spinnid on vastassuunalised (Pauli tõrkeprintsiip). Orbitaalide täitumise järjekorda kirjeldavad reeglid nagu Aufbaureegel ja Hundi reegel määravad, kuidas elektronid kõrgema või madalama energiaorbitaali hõivavad.
Tüübid ja kujud
Orbiatlid jagunevad peamiselt lähtuvalt azimutalkvantarvust l:
- s-orbitaal (l = 0) — sfääriline, ühe tipu kõige lihtsam orbitaal; igal n‑tasemel üks s-orbitaal.
- p-orbitaal (l = 1) — hantli-kujulised kolm orientatsiooni (ml = −1, 0, +1), esinevad alates 2. energiatasemest.
- d-orbitaal (l = 2) — keerukamad kujundid, viis orientatsiooni, olulised ülemineku-metalides.
- f-orbitaal (l = 3) — veel keerukamad, olulised haruldaste muldmetallide ja aktinoolide puhul.
Orbiatlitel on ka sõlmpinnad (nodes) — kohad, kus |ψ|2 = 0. Radiaalsed ja angulaarsed sõlmpinnad määravad orbitaalide energiat ja kuju.
Energiate ja täitumise põhimõtted
Orbitaalide energia sõltub peamiselt peamisest kvantarvust n ja l‑st, aga ka tuuma laengust ja elektronidevahelistest tõrgetest: ühesuguse n‑i puhul võivad madalama l‑iga orbiatlid olla tavaliselt madalama energiaga (näiteks 4s enne 3d). Orbitaalide degeneratsioon (sama energia erinevad orientatsioonid) võib olla murdunud välisväljade või keemiliste sidemete mõjul.
Roll keemias ja spektroskoopias
Orbitaalide kattumine määrab, kuidas aatomid moodustavad keemilisi sidemeid: molekulaarsed orbitaalid tekivad aatomorbitaalide lineaarsetest kombinatsioonidest, kus sidumine sõltub orbitaalide sümbioosist ja sümmeetriast. Keemilised omadused ja valentsed grafid tulenevad peamiselt väliskestade orbitaalide täitumisest ja orientatsioonist, mida kirjeldavad aatomite elektronkonfiguratsioonid.
Orbitaalide teooria ajalugu on seotud spektroskoopiaga: varased vaatlustulemused, näiteks teatavate leelismetallide spektroskoopilised jooned, andsid vihjeid tasemete struktuurile ning aitasid arendada kvantteooriat ja orbitaalmudelit.
Kvantmehaanikas ja teoreetilises keemias
Aatomiteoorias ja kvantmehaanikas on aatomi orbitaal kvantarv. Orbitaalide täpse kuju ja energiat arvutatakse Schrödingeri võrrandi lahenditest (hoolimata sellest, et täpne lahendus on olemas ainult vesinikulaadse aatomi jaoks), ning rohkemate elektronidega aatomite puhul kasutatakse lähendusi ja arvutusmeetodeid (Hartree–Fock, tiheda aine teooria jms).
Tähtsustamine lihtsas keeles
Lihtsustatult: orbitaal ütleb, kus elektroni tõenäoliselt leida saab, milline on selle energia ning millise kujuga see tõenäosusjaotus on. See on keskne mõiste nii aatomite mõistmisel, keemiliste sidemete prognoosimisel kui ka materjalide ja molekulide omaduste uurimisel.
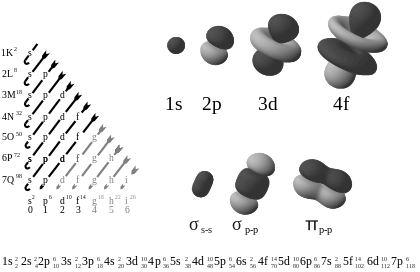
Vasakpoolsel joonisel on orbitaalid esitatud energia suurenemise järjekorras. Paremal on näited orbitaalide kuju kohta.
Seotud leheküljed
- Elektronpilv
- Molekulaarorbitaal
Küsimused ja vastused
K: Mis on aatomi orbitaalid?
V: Aatomiorbitaalid on aatomi tuuma ümbritsevad alad, kus elektronid kõige tõenäolisemalt asuvad.
K: Milline on matemaatiline funktsioon, mis kirjeldab elektronide käitumist aatomis?
V: Matemaatiline funktsioon, mis kirjeldab elektronide käitumist aatomis, on lainepõhine funktsioon.
K: Miks kasutatakse sõna "orbitaal"?
V: Sõna "orbitaal" kasutatakse tuuma ümbritsevate alade kirjeldamiseks, kus elektronid kõige tõenäolisemalt asuvad, sest kunagi arvati, et elektronid käituvad nagu planeedid, mis tiirlevad ümber Päikese.
K: Kuidas on määratletud aatomi orbitaalide arv elemendis?
V: Aatomi orbitaalide arv elemendis on määratud elemendi perioodiga.
K: Miks liiguvad elektronid orbitaalide vahel?
V: Elektronid liiguvad orbitaalide vahel sõltuvalt nende kiirusest ja teiste elektronide arvust.
K: Mis on aatomi orbitaal aatomiteoorias ja kvantmehaanikas?
V: Aatomi orbitaal on aatomiteoorias ja kvantmehaanikas kvantarv.
K: Mitu elektroni võib iga aatomi orbitaal hõivata?
V: Iga aatomi orbitaal võib olla hõivatud ühe või kahe elektroniga.
Otsige