Aatomimudel: aatomiteooria, ajalugu ja ülesehitus
Aatomimudel: põnev ülevaade aatomiteooria ajaloost, Demokritosest Daltonini ja aatomi ülesehitusest — prootonid, neutronid, elektronid ja kvargid lihtsalt selgitades.
Keemia ja füüsika valdkonnas selgitab aatomiteooria, kuidas meie arusaam aatomist on aja jooksul muutunud. Kunagi arvati, et aatomid on kõige väiksemad ainetükid. Nüüdseks on aga teada, et aatomid koosnevad prootonitest, neutronitest ja elektronidest. Need subatomaarsed osakesed koosnevad kvarkidest. Esimene idee aatomist pärineb kreeka filosoof Demokritoselt. Paljud kaasaegse teooria ideed pärinevad John Daltonilt, Briti keemikult ja füüsikult.
Teooria kehtib tahkede kehade, vedelike ja gaaside kohta, kuid see ei kehti analoogselt plasmade või neutrontähtede kohta.
Aatomimudelite ajalugu lühidalt
Aatomimõiste arenes läbi mitme sammu, kus iga uus mudel selgitas paremini katseandmeid:
- Demokritos (antiik): aatom kui jagamatu osake, filosoofiline idee.
- John Dalton (19. sajandi algus): keemilised aatomid eri massidega ja seaduspärasused keemilistes reaktsioonides.
- J. J. Thomson: katoodkiirkatsetest järeldus, et aatomis on laetud osakesed — elektronid (nn ploomipudingumudel).
- Ernest Rutherford: kuldlehestikatsed näitasid, et enamik massist ja positiivsest laengust on väga väikeses tuumas; aatom on enamasti ruumi ja tuum on keskel.
- Niels Bohr: sidus klassikalise elektrodünaamika kvantsete energiaastmetega, selgitas vesiniku spektrijooni.
- Kvantmehaanika (Schrödinger, Heisenberg jt): kirjeldab elektrone lainefunktsioonide ja tõenäosuste kaudu, tuletades kaasaegsed orbitaalid ja energiajaotused.
Aatomi ülesehitus
Aatom koosneb kahest põhiosast: väikesest, tihedast tuumast ja seda ümbritsevast elektronpilvest. Tuumas asuvad prootonid (positiivne laeng) ja neutronid (laenguta). Elektronid (negatiivne laeng) liiguvad tuuma ümber ja nende jaotus määrab aatomi keemilised omadused.
Olulised mõisted:
- Aatomnumber (Z) — prootonite arv tuumas; määrab keemilise elemendi.
- Massiarv (A) — prootonite + neutronite summa; määrab isotoobi massi.
- Isotoop — sama elemendi aatomid, millel erinev neutronite arv (nt süsiniku 12 ja 14).
- Ioon — aatom, mis on elektronide võidu või kaotuse tõttu laetud.
Elektronid, orbitaalid ja keemia
Kaasaegne aatomimudel ei kujuta elektrone kindlatel trajektooridel, vaid orbitaalidena — ruumipiirkondadena, kus elektroni leidmise tõenäosus on suur. Orbitaalide kuju (s, p, d, f) ja täitumine (Pauli keeld, Hundi reegel) selgitavad elementide keemilist käitumist ja perioodilisuse nähtust. Elektronide järjestatud energiatasemed ja elektronide vahetus määravad keemilised sidemed ja reaktsioonid.
Tuuma- ja tuumajõud
Kuigi prootonid omavad positiivset laengut ja peaksid elektromagnetiliselt tõrjuma üksteist, hoiavad neid koos tugevad tuumajõud (tuumajõud ehk tuumasidemed), mis toimivad väga lühikesel kaugusel. Tuumad võivad olla stabiilsed või radioaktiivsed — viimased lagunevad, kiirgates alfa-, beeta- või gammakiirgust. Tuumaenergia, mis eraldub teisendustel (näiteks lõhustumisel või ühinemisel), on seotud massi ja energia ekvivalentsusega (E = mc²).
Subatomaarosakesed ja kvargid
Prootonid ja neutronid ise ei ole elementaarosakesed, vaid koosnevad kvarkidest (peamiselt up- ja down-kvarkidest) ning neid vahendavad gluuonid. Elektron on praegu vaadeldud kui elementaarne fermion (leptoon), millel puudub sisemine struktuur teadaolevate katsete põhjal.
Mõõtmed ja ühikud
Tüüpilise aatomi suurus on ~10-10 meetrit (1 angström = 10-10 m). Tuuma läbimõõt aga on ~10-15 m (femtomeeter). Aine massi kirjeldamiseks kasutatakse tuumaosakestele areenil sageli aatommassiühikut (u) ja palju-koguste puhul Avogadro arvu (6,022·1023 üksust mooli kohta).
Eksperimentaalsed tõendid
Mõned tähtsamad katsed ja meetodid, mis aatomimudeleid kinnitasid:
- Katoodkiired (Thomson) — elektroni olemasolu avastamine.
- Guldlehestikatsed (Rutherford) — aatomi tuuma olemasolu tõestamine.
- Millikani õlitilga katsed — elektroni laengu mõõtmine.
- Spektroskoopia — elektronide kvantiseeritud energiaüleminekute nähtavus rida-spektrites.
- Tuumafüüsika eksperimendid ja kiirdetektorid — prootonite/neutronite ja kvarkide uurimine.
Piirangud ja erandid
Kuigi aatomiteooria kirjeldab hästi tahkeid aineid, vedelikke ja gaase, ei kehti see täpselt samamoodi ka kõigi olekute puhul. Näiteks:
- Plasma — ioniseerunud gaas, kus elektronid ja ioonid liiguvad vabalt, ning klassikalised aatomimudelid peavad arvestama kollektiivsete laengukäitumiste ning magnet- ja elektriväljadega.
- Neutrontähed — äärmuslikes tiheduse tingimustes võivad aatomi tuumad kokku variseda ja aine omadused juhitakse tuuma- või kvarkfaasidest, mida tavaline aatomimudel ei kirjuta.
Rakendused ja tähendus
Aatomimõistest sõltuvad paljud tänapäeva tehnoloogiad ja teadusharud: keemia ja materjaliteadus (reaktsioonide ja sidemete mõistmine), pooljuhtide ja elektronika arendus, tuumaenergia ja meditsiiniline diagnostika (nt tuumameditsiin, röntgen, MRI), ning põhjalikud katsed osakestefüüsikas. Samuti annab aatomiteuurimine aluse nano- ja kvanttehnoloogiatele.
Kokkuvõte
Aatomimudel on teaduse pidevas arengus olev kontseptsioon: varasemad lihtsustatud mudelid (tahkete punktide nähtus) on asendunud kvantmehaaniliste kirjeldustega, mis arvestavad tõenäosusi, orbitaale ja subatomaarseid koostisosi. Kuigi aatomiteooria töötab hästi igapäevases ainekirjelduses, nõuab ekstreemsete tingimuste (näiteks plasma või neutrontähed) selgitamine laiendatud füüsika- ja tuumamudeleid.

Demokritos oli kreeka filosoof, 460 eKr.

Roger Joseph Boscovich. Horvaatia jesuiit, kes esitas aatomiteooria prototüübi.

John Dalton (1766-1844), inglise keemik ja füüsik.
Sir Joseph John Thomson (1856-1940), inglise füüsik, avastas elektroni ja selle negatiivse laengu. Ta sai Nobeli füüsikapreemia
Demokritose aatomiteooria
Demokritos arvas, et kui midagi ikka ja jälle pooleks lõigata, tuleb lõpuks lõpetada. Ta ütles, et seda viimast ainetükki ei saa enam väiksemaks lõigata. Demokritos nimetas neid väikeseid ainetükke aatomiteks, mis tähendab "jagamatu". Ta arvas, et aatomid kestavad igavesti, ei muutu kunagi ja neid ei saa hävitada. Demokritos arvas, et aatomite vahel ei ole midagi ja et kõik meie ümber on seletatav, kui me mõistame, kuidas aatomid töötavad.
Mõned teised filosoofid nõustusid, teised aga ei nõustunud. Neil ei olnud võimalik eksperimente teha, et näidata, kas tema teooria on tõene või mitte.
Boscovichi aatomiteooria
1758. aastal kirjeldas Roger Joseph Boscovich aatomiteooria eelkäijat.
Daltoni aatomiteooria
1803. aastal töötas Cumberlandis sündinud inglise teadlane John Dalton Demokritose teooria ümber järgmiselt:
- Kogu aine koosneb aatomitest.
- Et aatomid on jagamatud ja nähtamatud osakesed.
- Et sama elemendi aatomid on sama tüüpi ja sama massiga.
- Aatomid, millest keemilised ühendid koosnevad, esinevad kindlaksmääratud proportsioonides.
- Keemilised muutused vastavad keemilises reaktsioonis osalevate aatomite ümberkorraldamisele.
Dalton defineeris aatomi kui elemendi põhiühiku, mis võib osaleda keemilises ühendis.
Thomsoni aatomimudel
1850. aastal konstrueeris Sir William Crookes "tühjendustoru", mis on klaasist toru, mille otstes on eemaldatud õhk ja metallelektroodid, mis on ühendatud kõrgepingeallikaga. Kui torus tekitatakse vaakum, võib näha valgusplahvatust, mis liigub katoodilt (negatiivselt laetud elektrood) anoodile (positiivselt laetud elektrood). Crookes nimetas seda emissiooni "katoodkiirguseks".
Pärast katoodkiirguse katseid tegi Sir Joseph John Thomson kindlaks, et kiirguse moodustasid negatiivsed laengud, sest neid tõmbas ligi positiivne poolus. Thomson teadis, et aatomid on elektriliselt neutraalsed, kuid ta tegi kindlaks, et selleks peaks aatomil olema sama palju negatiivseid ja positiivseid laenguid. Negatiivsed laengud nimetati elektronideks (e-).
Vastavalt aatomite neutraalse laengu kohta tehtud oletustele pakkus Thomson välja esimese aatomimudeli, mida kirjeldati kui positiivselt laetud kera, millesse elektronid olid paigutatud (negatiivse laenguga). See on tuntud kui ploomipudingi mudel.
1906. aastal tegi Robert Millikan kindlaks, et elektronide Coulombi (C) laeng on -1,6 * 10−19, mis võimaldas arvutada selle massi kui pisikese, 9,109 * 10 −31kg.
Samal ajal võimaldasid Eugene Goldsteini katsed 1886. aastal katoodlahenduslambidega kindlaks teha, et positiivsete laengute mass on 1,6726 * 10−27 kg ja elektrilaeng +1,6 * 10 C−19. Lord Ernest Rutherford nimetas hiljem need positiivselt laetud osakesed prootonideks.

Thomsoni mudeli skemaatiline kujutis.
Rutherfordi aatomimudel
Uus-Meremaa füüsik Ernest Rutherford esitas 1910. aastal idee, et aatomi positiivsed laengud asuvad peamiselt aatomi keskmes, tuumas, ja elektronid (e-) selle ümber.
Rutherford näitas seda, kui ta kasutas alfa-kiirguse allikat (heeliumist), et tabada väga õhukesi kuldlehti, mida ümbritses tsinksulfiidist lambivari, mis alfa-kiirguse tabamisel tekitas nähtavat valgust. Seda eksperimenti nimetati Geiger-Marsdeni eksperimendiks või kuldfooliumi eksperimendiks.
Selleks ajaks olid aatomi põhielemendid selge, lisaks avastati, et ühe elemendi aatomid võivad esineda isotoopidena. Isotoobid erinevad tuumas olevate neutronite arvu poolest. Kuigi see mudel oli hästi arusaadav, on tänapäeva füüsika edasi arenenud ja tänapäevaseid ideid ei saa lihtsalt arusaadavaks teha. Mõningat ettekujutust tänapäeva aatomifüüsikast võib leida alljärgnevas tabelis olevatest linkidest.
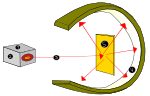
Lord Ernest Rutherfordi aatomikatsetus
Kaasaegne füüsika
Aatomid ei ole elementaarosakesed, sest nad koosnevad subatomaarsetest osakestest nagu prootonid ja neutronid. Ka prootonid ja neutronid ei ole elementaarosakesed, sest nad koosnevad veel väiksematest osakestest, mida nimetatakse kvarkideks ja mida ühendavad omavahel teised osakesed, mida nimetatakse gluoonideks (sest need "liimivad" kvarkid aatomis kokku). Kvarkid on elementaarosakesed, sest kvarke ei saa edasi lagundada.
Küsimused ja vastused
K: Mis on aatomiteooria?
V: Aatomiteooria selgitab, kuidas meie arusaam aatomist on aja jooksul muutunud.
K: Mida arvati kunagi aatomi kohta?
V: Kunagi arvati, et aatomid on kõige väiksemad ainetükid.
K: Millest aatomid tegelikult koosnevad?
V: Aatomid koosnevad prootonitest, neutronitest ja elektronidest.
K: Millest koosnevad subatomaarsed osakesed?
V: Subatomaarsed osakesed koosnevad kvarkidest.
K: Kes on see kreeka filosoof, kes esimesena mõtles välja aatomi idee?
V: Esimene idee aatomist tuli kreeka filosoof Demokritoselt.
K: Kes on Briti keemik ja füüsik, kes andis palju ideid kaasaegsesse teooriasse?
V: John Dalton, briti keemik ja füüsik, andis palju ideid moodsasse teooriasse.
K: Kas aatomiteooria kehtib plasmade või neutrontähtede kohta?
V: Teooria kehtib tahkete kehade, vedelike ja gaaside kohta, kuid see ei kehti analoogselt plasmade või neutrontähtede kohta.
Otsige