Sulfoksiid (sulfoxiid): struktuur, omadused ja DMSO keemias
Sulfoksiid (sulfoxiid): struktuur, omadused ja DMSO keemias – selge ülevaade chiraliteedist, ligandidest, reaktiivsustest ja praktilistest kasutusaladest.
Sulfoksiid on molekul, mille väävliaatom on seotud kahe süsiniku ja ühe hapniku aatomiga. See tekib tioeetrite oksüdeerimisel, ilma et see läheks sulfoonini. Nagu paljud väävlit sisaldavad molekulid, võib sulfoksiid mõnikord väga lõhnata — sageli tugevalt ja mõnikord küüslaugulaadselt.
Struktuur ja stereokeemia
Sulfoksiide võib üldistada valemiga R-S(=O)-R'. Väävel on hapnikuga kaksiksidemetes ja süsinikuga ühesidemetes, mis jätab väävliaatomile ka üksiku paari. Selle elektronpaaride ja sidemete paiknemise tõttu on väävliaatomi ümber olev geomeetria ligikaudu tetraeedriline. See seab tingimused selliseks, et väävel võib olla kiraalne keskus — paljudel sulfoksiididel on stabiilsed enantiomeerid, mida saab isoleerida ja kasutada asümmeetrilises sünteesis.
Füüsikalised ja keemilised omadused
- Polaarne funktsioon: S=O side on tugevalt polaarne, mistõttu sulfoksiidid on tavaliselt polaarsemad kui vastavad tioeetrid. See annab neile head lahusti- ja koordina omadused.
- Koordinatsioon ja ligandid: sulfoksiidid võivad toimida ligandina — nad siduvad üleminekumetallide keskusi, sageli läbi hapniku, kuid sõltuvalt metallist ja ligandi asukohast võib osutuda relevantselt ka väävli kaudu sidumine; seetõttu kasutatakse neid hea ligandina organisometallilises keemias.
- Reaktiivsus: sulfoksiidid osalevad mitmetes iseloomulikes reaktsioonides, nagu Pummereri rearrangeerumine ja mitmed oksüdeerimis-/reduktiivsed teisendused. Nad võivad kergesti edasioksüdeeruda sulfoonideks või reageerida erinevate aktivatsioonistega orgaaniliste transformatsioonide käivitamiseks.
Dimetüülsulfoksiid (DMSO)
Oluline ja laialt levinud sulfoksiid on dimetüülsulfoksiid (DMSO). Seda nimetatakse ka DMSO-ks. Seda kasutatakse lahustina paljudes reaktsioonides, eriti biokeemias, aga ka sünteetilises orgaanilises keemias ja katalüüsis. DMSO on tugevalt polaarne aproootne lahusti, väga hea lahusti nii ioonsele kui ka orgaanilisele ainele ning on täielikult segunev veega. DMSO-l on kõrge keemistemperatuur (umbes 189 °C) ja sulamistemperatuur ligikaudu 18,5 °C, mistõttu toatemperatuuril on see vedelikuks jääv aine.
DMSO kasutatakse ka reagentidena (nt Swern-oksüdeerimises, kus aktiveeritud DMSO oksüdeerib alkoholide aldehüüdideks või ketoonideks) ning kui polaarne kandeaine ravimite ning juhuslike molekulide sisenemisel kudedesse — sellest tuleneb DMSO-le iseloomulik omadus läbi naha imendumisel kanda endaga kaasa lahustatud aineid.
Süntees ja keemiatehnilised rakendused
- Sulfoksiidid saadakse peamiselt vastavate tioeetrite selektiivsel oksüdeerimisel — oksüdeerimisagentide valikul saab tihti vältida üleoksüdeerimist sulfoonideks.
- Sulfoksiidide funktsionaalsus teeb neist väärtuslikke vaheühendeid orgaanilises sünteesis; neid kasutatakse nii ligandi kui ka lähtematerjalina mitmetes transformatsioonides.
- Stereokeemilise konteksti tõttu kasutatakse mõningaid seotud sulfoxiide asümmeetrilistes sünteesistrateegiates ja katalüütilistes protsessides.
Tervis, lõhn ja ohutus
Sulfoksiidid võivad omada tugevat lõhna (nt DMSO-l ja dimetüülsulfiidil on iseloomulik lõhn). Kuigi paljud sulfoksiidid ei ole äärmiselt toksilised, võib DMSO ja mõned teised sulfoksiidid kergesti imenduda läbi naha ja viia kaasa lahustatud kemikaale — seepärast on laboritingimustes oluline kasutada kummikindaid ja kaitseriietust ning vältida otsest naha- või limaskestekontakti. Samuti tuleb tähele panna, et DMSO võib kõrgetel temperatuuridel dehüdreeruda või laguneda, eraldades ebameeldivaid ja/või mürgiseid lõhnu.
Kokkuvõte
Sulfoksiidid (R-S(=O)-R') on polaarseid S=O grupiga orgaanilised ühendid, mis mängivad tähtsat rolli nii lahustite kui ka reagendina ning ligandina katalüüsis ja orgaanilises sünteesis. Dimetüülsulfoksiid (DMSO) on nende hulgas kõige tuntum ja laialdasemalt kasutatav praktiline lahusti ning sünteetiline reagent, mille omadused teevad selle väga väärtuslikuks, kuid nõuavad ka tähelepanelikku käitlemist.
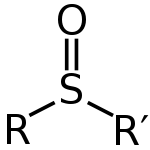
Sulfoksiidi üldine struktuur
Küsimused ja vastused
K: Mis on sulfoksiid?
V: Sulfoksiid on molekul, mille väävliaatom on seotud kahe süsiniku ja ühe hapniku aatomiga.
K: Kust pärineb sulfoksiid?
V: Sulfoksiid tekib tioeetrite oksüdeerimisel, ilma et see läheks sulfoonini.
K: Milline on sulfoksiidide üldvalem?
V: Sulfoksiidide üldvalem on R-S(=O)-R'.
K: Milline on aatomi kuju sulfoksiidides?
V: Aatomi kuju sulfoksiidides on tetraeedriline.
K: Kas väävel võib sulfoksiidides olla kiraalne keskus?
V: Jah, väävel võib sulfoksiidides olla kiraalne keskus.
K: Mis on dimetüülsulfoksiid ja milleks seda kasutatakse?
V: Dimetüülsulfoksiid, tuntud ka kui DMSO, on oluline sulfoksiidimolekul ja seda kasutatakse lahustina paljudes reaktsioonides, eriti biokeemias.
K: Miks kasutatakse sulfoksiide üleminekumetallide heaks ligandiks?
V: Sulfoksiide kasutatakse üleminekumetallide jaoks heade ligandidena, sest nad suudavad väävliaatomi elektronpaari tõttu metalliioonidega koordineeruda.
Otsige