Suunatud evolutsioon — meetod ensüümide ja valkude insenerimiseks
Suunatud evolutsioon: praktiline juhend ensüümide ja valkude insenerimiseks — in vivo/in vitro strateegiad, mutatsiooniraamatukogud, selektsioon ja rakendused biotehnoloogias.
Suunatud evolutsioon (DE) on laborimeetod, mida kasutatakse peamiselt ensüümide ja teiste valkude täiustamiseks tööstuslikel, biotehnoloogilistel või meditsiinilistel eesmärkidel. Tegemist on valgu insenerimise lähenemisega, mis jäljendab looduslikku valikut — st tekitatakse suur hulk varieeruvaid pärilikke variante ja seejärel valitakse või eraldatakse välja need, millel on soovitud omadused.
Põhiidee on järgmine: üks või mitu geeni muudetakse korduvate mutatsioonivoorusid, et luua suur variandiraamatukogu. Järgneb skriining või selektsioon, mille abil isoleeritakse need variandid, millel on soovitud funktsioon või omadus; need parimad variandid saavad malliks järgmise vooru jaoks. Selline iteratiivne tsükkel — muutmine, testimine ja valimine — kordub mitu korda, kuni saavutatakse nõutud omadused.
Peamised lähenemised mutageneesis ja raamatukogude loomisel
Suunatud evolutsiooni algfaasis muudetakse DNA-d, et tekitada mitmekesine variantide kogum. Levinud tehnikad on:
- Errare-prone PCR (vea-sissetoomise PCR) — juhuslike mutatsioonide tekitamine amplifikatsiooni käigus.
- DNA shuffling — mitme sarnase geeni fragmentide ümberkombineerimine, et luua rekombinante.
- Suunatud või saturatsioonmutagenees — kindlate aminohapete asendite sihipärane muutmine (nt kõikide asenduste testimine ühe positsiooni puhul).
- Transposoon- või kemiapõhised mutageneesimeetodid — juhuslike või fokuseeritud lõikude ja asenduste tekitamine.
Valik ja skriining — kuidas leida paremaid variante
Pärast raamatukogu loomist tuleb leida need variandid, mille omadused on soovitud. Kahe peamise lähenemise erinevus on:
- Selekteerimine (selection) — tingimused on üles seatud nii, et ainult soovitud funktsiooniga rakud või molekulid saavad ellu jääda või paljuneda. See on väga efektiivne, sest see võimaldab testida suuri raamatukogusid ilma iga üksikut varianti eraldi uurimata.
- Skriining (screening) — iga variantuuri omadusi mõõdetakse ja paremad eraldatakse. Skriining nõuab tavaliselt suuremat töömahtu, kuid võimaldab otsida spetsiifilisemaid omadusi.
Kõrge läbilaskvusega meetodid, mida tihti kasutatakse, hõlmavad phage display ja yeast surface display, ribosoomi- või mRNA-display süsteeme, samuti droplet-mikroflülektronika (mikrotilgad) ning FACS-i (rakuflötsentrifugaator) baasil tehtavat sorteerimist.
In vivo ja in vitro lähenemised
DE võib toimuda nii in vivo kui ka in vitro tingimustes. In vivo käigus transformeeritakse tavaliselt iga rakk (nt bakterid või pärmid) plasmiidiga, mis sisaldab erinevat variandiraamatukogu liiget. Ainult huvipakkuv geen erineb rakkude vahel, kõik muud geenid ja rakusüsteem jäävad ühtlaseks. Rakusisesed süsteemid on kasulikud, kui arendatav valk peab töötama elusorganismis või seal paljusid koostisosi nõuab (nt post-translatsiooniilised modifikatsioonid).
Sisemuseta in vitro evolutsioon kasutab sageli transkriptsioonitõlgendust või retsepti rakuvabas lahuses, et toota valke või RNA-d vabalt lahuses või kunstlike mikrotilkade sees. Selle eeliseks on suurem kontroll keskkonnatingimuste (temperatuur, pH, organilised lahustid jmt) üle ja asjaolu, et võimalik on ekspresseerida ka valke, mis oleksid elusrakkudele toksilised. Peale selle lubavad in vitro meetodid sageli palju suuremaid raamatukogusid (kuni 1015 varieeruvat molekuli), sest DNA-d ei pea rakkudesse sisestama. See piirab sageli seda, mida saab teha.
Taktikalised nüansid: iteratsioon, neutralne drift ja koondstruktuurid
Suunatud evolutsioon ei ole pelgalt juhuslike mutatsioonide generaator; efektiivne protsess nõuab läbimõeldud tsüklit ja mõõdikuid. Tihti kasutatakse:
- Mitut järjestikust vooru, kus iga vooru parimad variandid on malliks järgmise roundi mutageneesis.
- Neutraalseid mutatsioone ja kujundi diversifitseerimist (neutral drift), et uurida laiemat mutatsiooniruumi ja vältida kinnijäämist kohalikele maksimaaleile.
- Ristamise (recombination) ja fokuseeritud mutageneesi kombineerimist, et ühendada kasulikke mutatsioone erinevatest variantidest.
Näited ja rakendused
Suunatud evolutsioon on viinud mitmete praktikas oluliste toodete ja tööriistade tekkeni: ensüümid, mis taluvad kõrgemaid temperatuurisid või mittesoovitavaid keemilisi ained (nt pesemisainetööstus, toiduainetööstus), stabiilsemad ja tõhusamad polümeraasid nukleiinhapete töötlemiseks, optimiseeritud biokatalüsaatoreid biokütuste tootmises ning terapeutilised valgud ja antikehad meditsiinis. Kuulsad teaduslikud näited hõlmavad GFP-i ja erinevate ensüümide sujuvamat või muutunud aktiivsust.
Eelised ja piirangud
- Eelised: ei ole vaja täielikku mehhaanilist teadmistekogumit valgu toimimisest; tõestatud võime leida lahendusi, mida ratsionaalne disain ei suuda ennustada; sobib mitmetele rakendusvaldkondadele.
- Piirangud: nõuab head skriiningu- või selektsioonisüsteemi; suured raamatukogud ja iteratsioonid võivad olla ressursimahukad; mõnikord tekivad kasulikud mutatsioonid koos kuluka lisakuluga (nt madalam stabiliteet).
Turvalisus, eetika ja regulatsioon
Suunatud evolutsiooni eksperimente teostatakse reeglina biokaitse ja laboritingimuste nõudeid järgides. Kui kasutatakse patogeenseid mikroorganisme või uusi bioloogilisi funktsioone, siis kehtivad rangemad regulatsioonid ja eetikaküsimused. Arendus- ja tootmisetappides tuleb hinnata ka lõpptoodete toksilisust, immunogeensust ja keskkonnamõjusid.
Tulevik ja kombineerimine arvutusmeetoditega
Tänapäeval kombineeritakse suunatud evolutsiooni tihti computational protein design ja masinõppega, et prioriseerida mutatsioonitabeleid või kitsendada otsinguruumi — see kiirendab protsessi ja vähendab vajalikku katsetustööd. Mikrotilgasüsteemid ja automaatika võimaldavad teha järjest suuremaid ja täpsemalt juhitavaid eksperimente.
Kokkuvõttes on suunatud evolutsioon paindlik ja võimas lähenemine valkude ja ensüümide insenerimiseks, mis ühendab juhuslikkuse (mutatsioonid) sihipärase valikuga ning võimaldab saavutada praktiliselt kasulikke ja sageli ootamatuid parendusvariantide kombinatsioone.
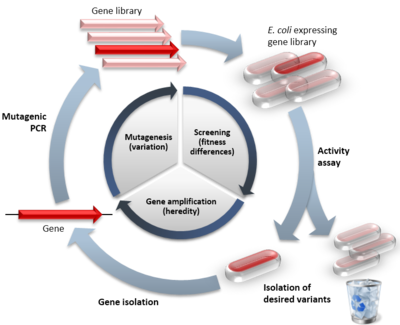
Näide suunatud evolutsioonist, võrreldes seda loodusliku evolutsiooniga. Sisemine tsükkel näitab suunatud evolutsioonitsükli kolme etappi, sulgudes on esitatud jäljendatud looduslik protsess. Välimine ring näitab tüüpilise eksperimendi etappe. Punased sümbolid tähistavad funktsionaalseid variante, kahvatud sümbolid tähistavad vähendatud funktsiooniga variante.
Pärilikkuse tagamine
Kui funktsionaalsed valgud on isoleeritud, on vaja, et nende geenid oleksid samuti, seega on vajalik genotüübi ja fenotüübi vaheline seos.
See võib olla kovalentne, kus mRNA geen on translatsiooni lõpus puromütsiini abil seotud valguga.
Alternatiivselt võib valku ja selle geeni hoida koos või emulsioonitilkades. Eraldatud geenijärjestused paljundatakse seejärel PCR-meetodil või transformeeritud peremeesbakterite abil. Järgmise mutageneesi vooru malliks võib kasutada kas üksikut parimat järjestust või järjestuste kogumit. Korduvad mitmekesistamise, valiku ja paljundamise tsüklid muudavad ensüümivariandid valikuprotsessiga sobivaks.

Ekspresseeritud valk võib olla kovalentselt seotud oma geeniga (nagu mRNA), vasakul, või panna sellega samasse kambrisse, paremal. Mõlemal juhul on valku kodeeriv geen isoleeritud.
Välja antud auhind
USA insener Frances Arnold on võitnud aastatuhande tehnoloogiaauhinna suunatud evolutsiooni teerajajana.
Küsimused ja vastused
K: Mis on suunatud areng?
V: Suunatud evolutsioon (DE) on meetod, mida kasutatakse ensüümide tootmiseks tööstuslikel või meditsiinilistel eesmärkidel. See on valkude muundamise vorm, mis jäljendab looduslikku valikut.
K: Kuidas toimib suunatud evolutsioon?
V: Suunatud evolutsioon toimib nii, et geen läbib korduvaid mutatsiooniringe, mille käigus luuakse variantide raamatukogu. Seejärel eraldatakse soovitud funktsiooniga geenid, mida kasutatakse järgmise vooru mallidena.
K: Kus saab suunatud evolutsiooni teha?
V: Suunatud evolutsiooni saab teha in vivo (elusates bakterite või pärmi rakkudes) või in vitro (vabalt lahuses või mikrotilkades).
K: Millised on suunatud evolutsiooni in vivo tegemise eelised?
V: Suunatud evolutsiooni tegemisel in vivo on eeliseks omaduste selekteerimine rakukeskkonnas, mis on kasulik, kui evolveeritud valku või RNA-d tahetakse kasutada elusorganismides.
K: Millised eelised on suunatud evolutsiooni tegemisel in vitro?
V: Suunatud evolutsiooni tegemisel in vitro on eeliseks see, et see võimaldab rohkem tingimusi (nt temperatuur, lahustid) ja see võimaldab ekspresseerida valke, mis oleksid rakkudele toksilised. Lisaks saab luua palju suuremaid raamatukogusid, sest DNA-d ei pea rakkudesse sisestama.
K: Mis piirab seda, mida saab teha in vitro eksperimendi käigus?
V: In vitro eksperimendi käigus tehtava töö piiriks on sageli see, kui palju DNAd tuleb rakkudesse sisestada.
Otsige