Mis on ensüüm? Ensüümid — biokatalüsaatorid, funktsioon ja tähtsus
Avasta, mis on ensüümid — biokatalüsaatorid, kuidas nad kiirendavad keemilisi reaktsioone, nende funktsioon ja tähtsus elusolendite ainevahetuses.
Ensüümid on rakkude valgumolekulid, mis toimivad bioloogiliste katalüsaatoritena. Ensüümid kiirendavad organismis toimuvaid keemilisi reaktsioone, kuid nad ei kasuta end protsessi käigus ära, mistõttu neid saab üha uuesti ja uuesti kasutada.
Peaaegu kõik elusolendite biokeemilised reaktsioonid vajavad ensüüme. Ensüümiga toimuvad keemilised reaktsioonid palju kiiremini kui ilma ensüümita.p39 Teised biokatalüsaatorid on katalüütilised RNA-molekulid, mida nimetatakse ribosüümideks.
Reaktsiooni alguses olevaid aineid nimetatakse substraatideks. Reaktsiooni lõpus olevad ained on produktid. Ensüümid töötavad substraatidega ja muudavad need toodeteks. Ensüümide uurimist nimetatakse ensümoloogiaks.
Esimene ensüüm leiti 1833. aastal Anselme Payeni poolt.
Struktuur ja toimemehhanism
Enamik ensüüme on valgud, millel on keerukas kolmemõõtmeline struktuur. Ensüümidel on aktiivne koht — väike osa valgumolekulist, kuhu substraat seondub. Aktiivses kohas toimub keemiline reaktsioon: ensüüm stabiliseerib üleminekuoleku ja alandab reaktsiooni aktivatsioonienergiat, mis kiirendab reaktsiooni kulgu.
Ensüümide toimemehhanismi kirjeldamiseks kasutatakse sageli mudeleid nagu lukku-ja-võti või kohanduva sobivuse (induced fit) mudelid. Neis seletustes rõhutatakse, et substraat ja ensüüm sobituvad omavahel spetsiifiliselt — ensüüm tunneb ära teatud substraadi või substraatide rühma.
Spetsiifilisus ja tüübid
- Substraat-spetsiifilisus: paljud ensüümid töötavad ainult ühe või mõne väga lähedase substraadiga.
- Reaktsioonispetsiifilisus: mõni ensüüm katalüüsib ainult teatud tüüpi keemilist reaktsiooni (nt hüdrolüüs, oksüdatsioon).
- Peamised ensüümiklassid (IUBMB EC-süsteem): oksüdoreduktaasid, transferaasid, hüdrolaasid, lüaasid, isomeraasid ja ligaasid.
Faktorid, mis mõjutavad ensüümide aktiivsust
- Temperatuur: igal ensüümil on optimaalse temperatuuri vahemik; liiga kõrge temperatuur võib põhjustada denaturatsiooni (struktuuri hävimist) ja aktiivsuse kaotust.
- pH: ensüümid töötavad parimalt teatud pH-l; happeline või aluseline keskkond võib muuta aktiivsete rühmade laengut ja seeläbi aktiivsust.
- Substraadi kontsentratsioon: suurem substraadi sisaldus võib tõsta reaktsiooni kiirust kuni punktini, kus kõik ensüümi molekulid on aktiivses kohas hõivatud (saturatsioon).
- Kofaktorid ja koensüümid: paljud ensüümid vajavad aktiivseks olemiseks täiendavaid mittevalgulisi ühendeid, nt metallioone või orgaanilisi koensüüme (näiteks NAD+, FAD).
- Inhibiitorid: inhibiitorid võivad ensüümi aktiivsust pärssida reversiibselt (konkurentsiline, mittekonkurentsiline) või irreversiibselt (püsiv inaktiveerimine).
Kinetika ja mõõtmine
Ensüümide kineetika kirjeldab, kuidas reaktsiooni kiirus sõltub substraadi ja ensüümi kontsentratsioonist. Levinud mudel on Michaelise–Menten kineetika, kus võtmetähtsusega parameetriteks on Vmax (maksimaalne kiirus) ja Km (Michaelise konstant — substraadi kontsentratsioon, mille juures kiirus on pool Vmax).
Ensüümide aktiivsust mõõdetakse sageli ühikutes (nt üksus = katalüüsitud substraadi hulk ajaühikus) ja laboris kasutatakse spektrofotomeetrilisi, kromatograafilisi või happe-baasi indikaatoreid lähtudes reaktsiooni tüübist.
Bioloogiline ja praktiline tähtsus
- Seedimine: ensüümid nagu amülaas, proteaasid ja lipaasid aitavad toitu lagundada ja imendumiseks ette valmistada.
- Metaboolsed protsessid: ensüümid osalevad ainevahetuses, energia tootmises (nt ATP süntees), DNA replikatsioonis ja parandamises (DNA ja RNA polümeraasid) ning raku signalisatsioonis.
- Meditsiin: ensüümpõhised testid aitavad diagnoosida haigusi (nt maksaensüümid, pankrease ensüümid), ensüümid võivad olla haiguse põhjuseks (ensüümide defitsiidid) või ravimi sihtmärgiks.
- Tööstus ja biotehnoloogia: ensüüme kasutatakse pesupesuvahendites plekieemaldamiseks, toidutööstuses (juustutootmine, leivatööstus), farmaatsias ravimite sünteesiks ja bioloogilises lagundamises.
Ajalugu ja terminoloogia
Esimese ensüümi avastas 1833. aastal Anselme Payen. Hiljem arendati ensüümide mõistmist edasi (sh Emil Fischeri lukku-ja-võti idee ning avastused rakkudest eraldunud ensüümide kohta). Tänapäeval klassifitseeritakse ensüüme rahvusvahelise süsteemi alusel ja neile antakse nimetused, mis peegeldavad katalüüsitavat reaktsiooni (nt laktaas, lipaas, katalaas).
Olulised mõisted lühidalt
- Aktivne koht: ensüümi osa, kus toimub substraadi seondumine ja katalüüs.
- Apoensüüm: valguosa, mis vajab funktsioneerimiseks kaasuvat kofaktorit.
- Holoensüüm: aktiivne ensüüm koos kõigi vajalike kofaktorite/koensüümidega.
- Denaturatsioon: ensüümi struktuuri pöördumatu hävimine soodustingimustes (nt kõrge temperatuur, äärmuslik pH).
Ensüümid on elusorganismide toimimise aluseks — ilma nendeta oleksid biokeemilised protsessid liiga aeglased, et elu säiliks. Nende uurimine ja rakendamine jätkab olulist rolli nii meditsiinis kui tööstuses, pakkudes vahendeid haiguste mõistmiseks, uute ravimite väljatöötamiseks ja keskkonnasõbralike tehnoloogiate loomiseks.
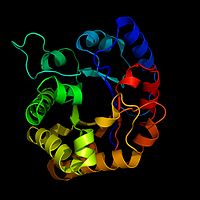
TIM-nimelise ensüümi lintdiagramm

TIM-nimelise ensüümi lintdiagramm
Ensüümi struktuur
On olemas tuhandeid erinevaid ensüüme ja igaüks neist on spetsiifiline reaktsioon, mida ta katalüüsib. Ensüümidel on nimed, mis näitavad, mida nad teevad. Ensüümide nimed lõppevad tavaliselt -aasiga, mis näitab, et tegemist on ensüümidega. Näiteks ATP-süntaas. See toodab kemikaali nimega ATP. Teine näide on DNA-polümeraas. See loeb intaktset DNA-ahelat ja kasutab seda uue ahela loomiseks.Üks näide ensüümidest on amülaas, mida leidub süljes. See lagundab tärklise molekulid väiksemateks glükoosi ja maltoosi molekulideks. Teine ensüüm on lipaas. See lagundab rasvad väiksemateks molekulideks, rasvhapeteks ja glütserooliks.d
Proteaasid on terve ensüümide klass. Nad lagundavad teisi ensüüme ja valke tagasi aminohapeteks. Nukleaasid on ensüümid, mis lõikavad DNA-d või RNA-d, sageli konkreetses kohas molekulis.
Ensüümid ei ole mõeldud mitte ainult suurte kemikaalide lagundamiseks väiksemateks kemikaalideks. Teised ensüümid võtavad väiksemaid kemikaale ja ehitavad need suuremateks kemikaalideks ning täidavad mitmeid muid keemilisi ülesandeid. Alljärgnevas liigituses on loetletud peamised tüübid.
Biokeemikud joonistavad sageli ensüümi pildi, mida kasutatakse ensüümi visuaalse abivahendina või kaardina. Seda on raske teha, sest ensüümis võib olla sadu või tuhandeid aatomeid. Biokeemikud ei saa kõiki neid detaile joonistada. Selle asemel kasutavad nad ensüümide piltidena lintmudeleid. Lintmudelite abil saab näidata ensüümi kuju, ilma et peaks iga aatomi joonistama.
Enamik ensüüme ei toimi, kui temperatuur ja pH ei ole just õiged. Imetajatel on õige temperatuur tavaliselt umbes 37Co kraadi (kehatemperatuur). Õige pH võib olla väga erinev. Pepsiin on näide ensüümist, mis töötab kõige paremini, kui pH on umbes 1,5.
Ensüümi kuumutamine üle teatava temperatuuri hävitab ensüümi jäädavalt. Proteaas lagundab selle ja kemikaalid võetakse uuesti kasutusele.
Mõned kemikaalid võivad aidata ensüümidel oma tööd veelgi paremini teha. Neid nimetatakse aktivaatoriteks. Mõnikord võib kemikaal ensüümi tööd aeglustada või isegi panna ensüümi üldse mitte töötama. Neid nimetatakse inhibiitoriteks. Enamik ravimeid on kemikaalid, mis kas kiirendavad või aeglustavad mõnda ensüümi inimkehas.
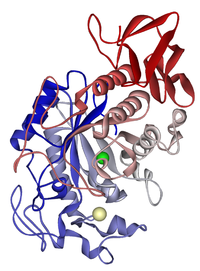
Sülje amülaas: kloriidioon roheline; kaltsium beež
Ensüümi struktuur
On olemas tuhandeid erinevaid ensüüme ja igaüks neist on spetsiifiline reaktsioon, mida ta katalüüsib. Ensüümidel on nimed, mis näitavad, mida nad teevad. Ensüümide nimed lõppevad tavaliselt -aasiga, mis näitab, et tegemist on ensüümidega. Näiteks ATP-süntaas. See toodab kemikaali nimega ATP. Teine näide on DNA-polümeraas. See loeb intaktset DNA-ahelat ja kasutab seda uue ahela loomiseks.Üks näide ensüümidest on amülaas, mida leidub süljes. See lagundab tärklise molekulid väiksemateks glükoosi ja maltoosi molekulideks. Teine ensüüm on lipaas. See lagundab rasvad väiksemateks molekulideks, rasvhapeteks ja glütserooliks.d
Proteaasid on terve ensüümide klass. Nad lagundavad teisi ensüüme ja valke tagasi aminohapeteks. Nukleaasid on ensüümid, mis lõikavad DNA-d või RNA-d, sageli konkreetses kohas molekulis.
Ensüümid ei ole mõeldud mitte ainult suurte kemikaalide lagundamiseks väiksemateks kemikaalideks. Teised ensüümid võtavad väiksemaid kemikaale ja ehitavad need suuremateks kemikaalideks ning täidavad mitmeid muid keemilisi ülesandeid. Alljärgnevas liigituses on loetletud peamised tüübid.
Biokeemikud joonistavad sageli ensüümi pildi, mida kasutatakse ensüümi visuaalse abivahendina või kaardina. Seda on raske teha, sest ensüümis võib olla sadu või tuhandeid aatomeid. Biokeemikud ei saa kõiki neid detaile joonistada. Selle asemel kasutavad nad ensüümide piltidena lintmudeleid. Lintmudelite abil saab näidata ensüümi kuju, ilma et peaks iga aatomi joonistama.
Enamik ensüüme ei toimi, kui temperatuur ja pH ei ole just õiged. Imetajatel on õige temperatuur tavaliselt umbes 37Co kraadi (kehatemperatuur). Õige pH võib olla väga erinev. Pepsiin on näide ensüümist, mis töötab kõige paremini, kui pH on umbes 1,5.
Ensüümi kuumutamine üle teatava temperatuuri hävitab ensüümi jäädavalt. Proteaas lagundab selle ja kemikaalid võetakse uuesti kasutusele.
Mõned kemikaalid võivad aidata ensüümidel oma tööd veelgi paremini teha. Neid nimetatakse aktivaatoriteks. Mõnikord võib kemikaal ensüümi tööd aeglustada või isegi panna ensüümi üldse mitte töötama. Neid nimetatakse inhibiitoriteks. Enamik ravimeid on kemikaalid, mis kas kiirendavad või aeglustavad mõnda ensüümi inimkehas.

Sülje amülaas: kloriidioon roheline; kaltsium beež
Luku ja võtme mudel
Ensüümid on väga spetsiifilised. Emil Fischer pakkus 1894. aastal välja, et nii ensüümil kui ka substraadil on spetsiifilised, teineteist täiendavad geomeetrilised kujud, mis sobivad täpselt üksteisega. Seda nimetatakse sageli "luku ja võtme" mudeliks. See mudel ei seleta siiski seda, mis juhtub edasi.1958. aastal tegi Daniel Koshland ettepaneku muuta lukkude ja võtmete mudelit. Kuna ensüümid on üsna paindlikud struktuurid, kujundatakse aktiivne ala ümber substraadiga toimuvate vastastikmõjude tõttu. Selle tulemusena ei seondu substraat lihtsalt jäiga aktiivse koha külge. Aktiivse koha aminohapete külgahelad painduvad sellisesse asendisse, et ensüüm teeks oma katalüütilist tööd. Mõnel juhul, näiteks glükosidaaside puhul, muudab substraadi molekul aktiivsesse kohta sisenedes ka veidi oma kuju.
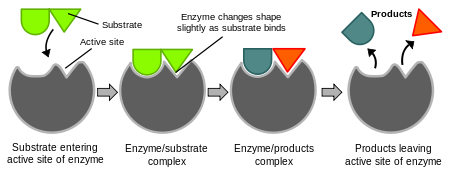
Diagrammid, mis näitavad ensüümide toime indutseeritud sobivuse hüpoteesi
Luku ja võtme mudel
Ensüümid on väga spetsiifilised. Emil Fischer pakkus 1894. aastal välja, et nii ensüümil kui ka substraadil on spetsiifilised, teineteist täiendavad geomeetrilised kujud, mis sobivad täpselt üksteisega. Seda nimetatakse sageli "luku ja võtme" mudeliks. See mudel ei seleta siiski seda, mis juhtub edasi.1958. aastal tegi Daniel Koshland ettepaneku muuta lukkude ja võtmete mudelit. Kuna ensüümid on üsna paindlikud struktuurid, kujundatakse aktiivne ala ümber substraadiga toimuvate vastastikmõjude tõttu. Selle tulemusena ei seondu substraat lihtsalt jäiga aktiivse koha külge. Aktiivse koha aminohapete külgahelad painduvad sellisesse asendisse, et ensüüm teeks oma katalüütilist tööd. Mõnel juhul, näiteks glükosidaaside puhul, muudab substraadi molekul aktiivsesse kohta sisenedes ka veidi oma kuju.

Diagrammid, mis näitavad ensüümide toime indutseeritud sobivuse hüpoteesi
Funktsioon
Ensüümireaktsiooni üldine võrrand on:
Substraat + ensüüm -> Substraat:ensüüm -> Toode:ensüüm -> Toode + ensüüm
Ensüümid vähendavad reaktsiooni aktiveerimisenergiat, moodustades substraadiga vahekompleksi. Seda kompleksi nimetatakse ensüümi-substraadi kompleksiks.
Näiteks saharaas, mis on 400 korda suurem kui tema substraat sahharoos, lõhustab sahharoosi selle koostisosadeks, milleks on glükoos ja fruktoos. Saharaas painutab sahharoosi ja pinguldab glükoosi ja fruktoosi vahelist sidet. Veemolekulid ühinevad ja teevad lõhustumise sekundi murdosa jooksul. Ensüümidel on järgmised põhiomadused:
- Nad on katalüütilised. Tavaliselt suurendavad nad reaktsiooni kiirust 10 miljardit korda.p39 Ensüüm ise ei muutu reaktsiooni käigus.
- Need on tõhusad väikestes kogustes. Üks ensüümimolekul võib muundada 1000 molekuli substraati minutis ja mõned neist võivad minutis muundada 3 miljonit molekuli.p39
- Need on väga spetsiifilised. Üks ensüüm teostab ainult ühe paljudest reaktsioonidest, milleks substraat on võimeline.
Ensüümi aktiivsuse kontroll
Ensüümide aktiivsust kontrollitakse rakus peamiselt viiel viisil.
- Ensüümide tootmist (ensüümide geenide transkriptsiooni ja translatsiooni) saab suurendada või vähendada vastusena muutustele raku keskkonnas. Seda geeniregulatsiooni vormi nimetatakse ensüümi induktsiooniks ja inhibeerimiseks. Näiteks antibiootikumidele, näiteks penitsilliinile, resistentsetes bakterites indutseeritakse ensüüme, mis hüdrolüüsivad penitsilliini molekuli.
- Ensüümid võivad esineda erinevates rakukompartimentides. Näiteks sünteesivad rasvhappeid üks ensüümide kogum tsütosoolis, endoplasmaatilises retikulumis ja Golgi aparaadis. Seejärel kasutab neid teine ensüümide kogum energiaallikana mitokondrites.
- Ensüüme saab reguleerida nende enda toodetega. Näiteks inhibeerivad lõpptoode(d) sageli ühte raja esimestest ensüümidest. Sellist regulatsioonimehhanismi nimetatakse negatiivseks tagasiside mehhanismiks, sest toodetud lõppprodukti kogust reguleerib selle enda kontsentratsioon. See takistab rakke tootmast liiga palju ensüümi. Ensüümide tegevuse kontrollimine aitab elusorganismides hoida stabiilset sisekeskkonda.
- Ensüüme saab reguleerida, kui neid pärast nende tootmist modifitseeritakse. Üks näide on polüpeptiidahela lõhustamine. Kümotrüpsiin, seedeproteaas, toodetakse kõhunäärmes inaktiivsel kujul ja transporditakse sellisel kujul maole, kus see aktiveeritakse. See peatab ensüümi seedimise kõhunäärme või muude kudede seedimise enne, kui see jõuab soolestikku. Seda tüüpi ensüümi mitteaktiivset eelkäijat nimetatakse zümogeeniks.
- Mõned ensüümid võivad aktiveeruda, kui nad liiguvad teise keskkonda (nt kõrgest pH-st madalasse pH-sse). Näiteks gripiviiruse hemagglutiniin aktiveerub kuju muutumisel. Selle põhjuseks on happelised tingimused, mis valitsevad peremeesraku lüsosoomi sees.
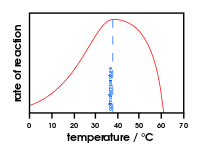
Graafik, mis näitab temperatuuri muutumise mõju ensüümi aktiivsusele
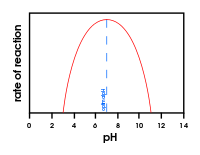
Graafik, mis näitab pH muutumise mõju ensüümi aktiivsusele
Funktsioon
Ensüümireaktsiooni üldine võrrand on:
Substraat + ensüüm -> Substraat:ensüüm -> Toode:ensüüm -> Toode + ensüüm
Ensüümid vähendavad reaktsiooni aktiveerimisenergiat, moodustades substraadiga vahekompleksi. Seda kompleksi nimetatakse ensüümi-substraadi kompleksiks.
Näiteks saharaas, mis on 400 korda suurem kui tema substraat sahharoos, lõhustab sahharoosi selle koostisosadeks, milleks on glükoos ja fruktoos. Saharaas painutab sahharoosi ja pinguldab glükoosi ja fruktoosi vahelist sidet. Veemolekulid ühinevad ja teevad lõhustumise sekundi murdosa jooksul. Ensüümidel on järgmised põhiomadused:
- Nad on katalüütilised. Tavaliselt suurendavad nad reaktsiooni kiirust 10 miljardit korda.p39 Ensüüm ise ei muutu reaktsiooni käigus.
- Need on tõhusad väikestes kogustes. Üks ensüümimolekul võib muundada 1000 molekuli substraati minutis ja mõned neist võivad minutis muundada 3 miljonit molekuli.p39
- Need on väga spetsiifilised. Üks ensüüm teostab ainult ühe paljudest reaktsioonidest, milleks substraat on võimeline.
Ensüümi aktiivsuse kontroll
Ensüümide aktiivsust kontrollitakse rakus peamiselt viiel viisil.
- Ensüümide tootmist (ensüümide geenide transkriptsiooni ja translatsiooni) saab suurendada või vähendada vastusena muutustele raku keskkonnas. Seda geeniregulatsiooni vormi nimetatakse ensüümi induktsiooniks ja inhibeerimiseks. Näiteks antibiootikumidele, näiteks penitsilliinile, resistentsetes bakterites indutseeritakse ensüüme, mis hüdrolüüsivad penitsilliini molekuli.
- Ensüümid võivad esineda erinevates rakukompartimentides. Näiteks sünteesivad rasvhappeid üks ensüümide kogum tsütosoolis, endoplasmaatilises retikulumis ja Golgi aparaadis. Seejärel kasutab neid teine ensüümide kogum energiaallikana mitokondrites.
- Ensüüme saab reguleerida nende enda toodetega. Näiteks inhibeerivad lõpptoode(d) sageli ühte raja esimestest ensüümidest. Sellist regulatsioonimehhanismi nimetatakse negatiivseks tagasiside mehhanismiks, sest toodetud lõppprodukti kogust reguleerib selle enda kontsentratsioon. See takistab rakke tootmast liiga palju ensüümi. Ensüümide tegevuse kontrollimine aitab elusorganismides hoida stabiilset sisekeskkonda.
- Ensüüme saab reguleerida, kui neid pärast nende tootmist modifitseeritakse. Üks näide on polüpeptiidahela lõhustamine. Kümotrüpsiin, seedeproteaas, toodetakse kõhunäärmes inaktiivsel kujul ja transporditakse sellisel kujul maole, kus see aktiveeritakse. See peatab ensüümi seedimise kõhunäärme või muude kudede seedimise enne, kui see jõuab soolestikku. Seda tüüpi ensüümi mitteaktiivset eelkäijat nimetatakse zümogeeniks.
- Mõned ensüümid võivad aktiveeruda, kui nad liiguvad teise keskkonda (nt kõrgest pH-st madalasse pH-sse). Näiteks gripiviiruse hemagglutiniin aktiveerub kuju muutumisel. Selle põhjuseks on happelised tingimused, mis valitsevad peremeesraku lüsosoomi sees.

Graafik, mis näitab temperatuuri muutumise mõju ensüümi aktiivsusele

Graafik, mis näitab pH muutumise mõju ensüümi aktiivsusele
Ensüümi inhibiitorid
Inhibiitoreid saab kasutada selleks, et peatada ensüümi sidumine substraadiga. Seda võib teha selleks, et aeglustada ensüümi poolt kontrollitud reaktsiooni. Inhibiitorid sobivad lõdvalt või osaliselt ensüümi aktiivsesse kohta. See takistab või aeglustab ensüümi-substraadi kompleksi moodustumist.
Ensüümi inhibiitorid
Inhibiitoreid saab kasutada selleks, et peatada ensüümi sidumine substraadiga. Seda võib teha selleks, et aeglustada ensüümi poolt kontrollitud reaktsiooni. Inhibiitorid sobivad lõdvalt või osaliselt ensüümi aktiivsesse kohta. See takistab või aeglustab ensüümi-substraadi kompleksi moodustumist.
Denaturatsioon
Denaturatsioon on ensüümi aktiivse koha pöördumatu muutus, mis on põhjustatud temperatuuri või pH äärmuslikust muutusest. See vähendab reaktsioonikiirust, sest substraadi molekul ei mahu aktiivsesse kohta, mistõttu ei saa moodustada tooteid.
Denaturatsioon
Denaturatsioon on ensüümi aktiivse koha pöördumatu muutus, mis on põhjustatud temperatuuri või pH äärmuslikust muutusest. See vähendab reaktsioonikiirust, sest substraadi molekul ei mahu aktiivsesse kohta, mistõttu ei saa moodustada tooteid.
Kofaktorid
Kofaktorid ehk koensüümid on abimolekulid, mida on vaja ensüümi toimimiseks. Need ei ole valgud ja võivad olla orgaanilised või anorgaanilised molekulid. Mõlemat tüüpi molekulid sisaldavad mõnikord keskmes metalliiooni, näiteks Mg2+, Cu2+, Mn2+ või raua-väävli klastreid. See on tingitud sellest, et sellised ioonid võivad toimida elektronidoonoritena ja see on paljudes reaktsioonides oluline. Ensüümide vajadus erinevate väikeste abiainete järele on põhiline põhjus, miks loomad, sealhulgas meie ise, vajavad mikroelemente ja vitamiine.
Kofaktorid
Kofaktorid ehk koensüümid on abimolekulid, mida on vaja ensüümi toimimiseks. Need ei ole valgud ja võivad olla orgaanilised või anorgaanilised molekulid. Mõlemat tüüpi molekulid sisaldavad mõnikord keskmes metalliiooni, näiteks Mg2+, Cu2+, Mn2+ või raua-väävli klastreid. See on tingitud sellest, et sellised ioonid võivad toimida elektronidoonoritena ja see on paljudes reaktsioonides oluline. Ensüümide vajadus erinevate väikeste abiainete järele on põhiline põhjus, miks loomad, sealhulgas meie ise, vajavad mikroelemente ja vitamiine.
Klassifikatsioon
Ensüümid on klassifitseeritud Rahvusvahelise Biokeemia Liidu poolt. Nende ensüümide komisjon on rühmitanud kõik teadaolevad ensüümid kuude klassi:
- Oksido-reduktaasid: katalüüsivad elektronide ülekandmist.
- Transferaasid: liigutavad funktsionaalset rühma ühelt molekulile teisele
- Hüdrolüüsid: lisavad -OH (hüdroksüül)-rühma.
- Lüaasid: lõhustavad keemilisi sidemeid ja lisavad sageli kaksiksideme või ringstruktuuri
- Isomeraasid: A -> B, kus B on A isomeer.
- Ligasid: ühendavad kaks suurt molekuli: Ab + C -> A-C + b
Üksikutele ensüümidele antakse neljakohaline number, mis klassifitseerib neid andmebaasis. p145
Klassifikatsioon
Ensüümid on klassifitseeritud Rahvusvahelise Biokeemia Liidu poolt. Nende ensüümide komisjon on rühmitanud kõik teadaolevad ensüümid kuude klassi:
- Oksido-reduktaasid: katalüüsivad elektronide ülekandmist.
- Transferaasid: liigutavad funktsionaalset rühma ühelt molekulile teisele
- Hüdrolüüsid: lisavad -OH (hüdroksüül)-rühma.
- Lüaasid: lõhustavad keemilisi sidemeid ja lisavad sageli kaksiksideme või ringstruktuuri
- Isomeraasid: A -> B, kus B on A isomeer.
- Ligasid: ühendavad kaks suurt molekuli: Ab + C -> A-C + b
Üksikutele ensüümidele antakse neljakohaline number, mis klassifitseerib neid andmebaasis. p145
Ensüümide kasutamine
Ensüüme kasutatakse kaubanduslikult:
- imikutoidu valmistamine - imikutele mõeldud eelsuundamise toidu valmistamine
- šokolaadi keskosa pehmendamine
- bioloogiline pesupulber, mis sisaldab proteaasi ensüüme, mis lagundavad mustuse ja mustuse. See lagundab suured, lahustumatud molekulid väikesteks, lahustuvateks molekulideks. See töötab madalamal temperatuuril, seega on vaja vähem energiat (termostabiilne).
Ensüümide kasutamine
Ensüüme kasutatakse kaubanduslikult:
- imikutoidu valmistamine - imikutele mõeldud eelsuundamise toidu valmistamine
- šokolaadi keskosa pehmendamine
- bioloogiline pesupulber, mis sisaldab proteaasi ensüüme, mis lagundavad mustuse ja mustuse. See lagundab suured, lahustumatud molekulid väikesteks, lahustuvateks molekulideks. See töötab madalamal temperatuuril, seega on vaja vähem energiat (termostabiilne).
Seotud leheküljed
- Plahvatuse kineetika
Seotud leheküljed
- Plahvatuse kineetika
Küsimused ja vastused
K: Mis on ensüüm?
V: Ensüüm on rakkude valgumolekul, mis toimib bioloogilise katalüsaatorina.
K: Milline on ensüümide funktsioon organismis?
V: Ensüümid kiirendavad organismis toimuvaid keemilisi reaktsioone, kuid ei kulu selle käigus ära, nii et neid saab kasutada ikka ja jälle.
K: Kas kõik elusolendite biokeemilised reaktsioonid vajavad ensüüme?
V: Jah, peaaegu kõik elusolendite biokeemilised reaktsioonid vajavad ensüüme.
K: Mis on substraadid?
V: Substraadid on ained, mis on reaktsiooni alguses.
K: Mis on produktid?
V: Tooted on ained reaktsiooni lõpus.
K: Kuidas nimetatakse ensüümide uurimist?
V: Ensüümide uurimist nimetatakse ensümoloogiaks.
K: Kes avastas esimese ensüümi?
V: Esimese ensüümi avastas 1833. aastal Anselme Payen.
Otsige