Keletroopilised reaktsioonid: definitsioon, mehhanism ja näited
Keletroopilised reaktsioonid — selge definitsioon, mehhanism ja praktilised näited (ketroopilised ekstrusioonid, CO või N2 eraldumine). Samm-sammult mehhanism ja skeemid.
Keletroopilised reaktsioonid on peritsükliliste reaktsioonide alamliik, kus üks aatom ühel reaktiivil moodustab samaaegselt kaks uut sidet sama pi-süsteemi kahe otsaga. Peritsükliline reaktsioon hõlmab üleminekuolekut, kus aatomid ja vastavad orbitaalid on järjestatud tsükliliselt ning selles tsüklilises massiivis toimub σ- ja π-sidemete ümberkorraldamine. Keletroopilised protsessid on sellest vaatenurgast eriline juhtum, sest mõlemad uued sidemed tekivad ühe ja sama aatomi kaudu, mistõttu neid käsitletakse sageli kui [n+1] tüüpi peritsüklilisi reaktsioone (nt [2+1], [4+1]).
Keletroopilised reaktsioonid jagunevad peamiselt kaheks: keletroopiline additsioon, kus üks aatom lisandub pi-süsteemile ja moodustab kaks sidet (näiteks karbeeni + alkeeni → tsüklopropaan), ning keletroopiline ekstrusioon, kus tsüklilisest molekulist eraldub väike lineaarne või gaasiline molekul (nt CO või N2) ja samal ajal tekib uus pi-süsteem. Joonisel 1 on paremal esitatud mõned näited. Esimesel juhul võib ainsa aatomi rollis olla näiteks karbonüülrühma süsinikuaatom, mis lõppkokkuvõttes vabaneb või satub süsinikmonooksiidiks. Selliseid ekstrusioone nimetatakse sageli keletroopilisteks ekstrusioonideks, sest reaktsioonis eraldub väike stabiilne molekul. Nende reaktsioonide liikumapanevaks jõuks on sageli gaasi (nt CO või N2) vabanemisest tulenev entroopiline kasu, aga samuti võivad kaasa aidata aromaatse või hüdrostabiilsema toote teke ning pingeseisu leevenemine.
Mehhanism ja orbitaalsümmeetria
Keletroopilised reaktsioonid on tavaliselt konserted – kõik sidemete tekitamise/katkejate üleminek toimub ühes katkestamatusse elektronitsüklis. Selle käitumise mõistmiseks kasutatakse Woodward–Hoffmanni orbitaalsümmeetria printsiipe: sõltuvalt elektroniarvust ja orbitalsete faaside koordineeritusest võib reaktsioon olla termiliselt lubatud suprafaciaalsel või antarfaciaalsel teel. Praktikas tähendab see, et keletroopiliste lisandite stereokeemia ja reaktiivsus sõltub lähtereaktiivide orbitaalide faasisuhtest; näiteks sujuvad suprafaciaalsed kursused annavad tavaliselt stereospesifilise tulemuse.
Tuleb aga tähele panna, et mõningad protsessid, mis näivad keletroopilised, võivad toimuda ka samm-sammuliste (radikaalsete või iooniliste) mehhanismide kaudu – eriti juhul, kui osaleb triplet-karbeen või tugev polaarsus. Näiteks singlet-karbeenid annavad sageli stereospesifilisi konserted lisandusi, samas kui triplet-karbeenidega toimuvad samm-mehhanismid võivad viia stereokeemia kaoks.
Tüüpilised näited ja rakendused
- Karbeeni lisandumine alkeenidele (tsüklopropanatsioon) – klassikaline keletroopiline [2+1] additsioon, kus üks süsinikuaatom (karbeen) moodustab samaaegselt kaks σ-sidet alkeeni kahe süsinikuga, andes tsüklopropaani. Selles rühmas on suurt tähtsust sünteetil keemias, sest tsüklopropaanide moodustumine võimaldab konstruktse lähenemise keerukate molekulide koostamisel.
- SO2 lisandumine ja ekstrusioon – rida konjugeeritud dienide reageerimisel vääveldioksiidiga annab cheletroopilisi tooteid (näiteks sulfoleenid). Tagasireaktsioon ehk termiline ekstrusioon vabastab SO2 ja taastab dieni või moodustab teise, enam-vähem aromaatse toote, mida saab kasutada SO2 talletamiseks või vabanemiseks kontrollitud tingimustel.
- CO ja N2 ekstrusioon – mitmetest tsüklitest või heterotsüklitest võib termolüütilisel teel eralduda CO või N2, mis on tüüpiline keletroopiline lagunemine. Näiteks α-püroonide ja mõnede norbornadieeni derivaadi termolüütiline lagunemine võib anda CO ja aromaatse toote; N2 eraldumine on sageli eriti tõhus entroopilise kasu tõttu.
- Sünteetiline tähendus – keletroopilisi reaktsioone kasutatakse sihipäraselt tsüklopropaanide valmistamiseks, heterotsüklite moodustamiseks või väikeste gaasiliste molekulide eemaldamiseks, mis võib kiirendada reaktsioonide suunamist ja toote isolatsiooni.
Stereokeemia ja kineto-termodünaamilised aspektid
Keletroopilised lisandused, mis kulgevad konserted teel ja kus lisandaja on pöördumatu orbitalne partner (nt singlet-karbeen), on tavaliselt stereospesifilised — alusalkeeni konfiguratsioon kajastub toodetes. Kui aga reaktsioon hõlmab radikaalset või ioonset vaheühendit või kui lisandaja on triplet-olekus, võib stereospesifilisus kaduda. Paljud keletroopilised ekstrusioonid on temperatuuriliselt soodustatud: kuumus annab energia üleminekuseisundile ja suurendab gaasi eraldumise entropilist panust, mis võib nihutada tasakaalu ekstrusiooni kasuks.
Kokkuvõte
Keletroopilised reaktsioonid on spetsiifiline ja praktiline peritsükliliste protsesside rühm, kus üks aatom moodustab samaaegselt kaks sidet või, vastupidi, eraldub kui väike molekul. Nende mõistmine tugineb orbitaalsete suhtluste analüüsile ja Woodward–Hoffmanni reeglitele ning neil on tähtis roll nii fineerkeemias (tsüklopropaanide valmistamine, heterotsüklid) kui ka mehhanistikeskkonnas (gaaside vabanemisest tingitud entroopia) ja sünteetilistes strateegiates.

Joonis 1. Peritsüklilised reaktsioonid
Teoreetiline analüüs
Keletroopsetes reaktsioonides osalevate molekulide geomeetria tõttu kinnitavad need mitmeid teoreetiliste keemikute poolt tehtud prognoose. Heletroopilised reaktsioonid kinnitavad molekuli orbitaalide sümmeetria säilimist.
Peritsüklilises ülemineku olekus loovutab väike molekul kaks elektroni ringile. Reaktsiooni võib seletada kaks võimalikku geomeetriat. Väike molekul võib läheneda kas lineaarselt või mittelineaarselt. Lineaarsel lähenemisel on väikese molekuli orbitaali elektronid suunatud otse suure molekuli π-süsteemi. Mitte-lineaarse lähenemise korral läheneb orbitaal veidi kõrvalise nurga all. π-süsteemi võime pöörelda, kui väike molekul läheneb, on uute sidemete moodustamisel otsustava tähtsusega. Pöörlemissuund on erinev sõltuvalt sellest, kui palju π-elektroneid süsteemis on. Allpool on näidatud skeem kahe elektroniga fragmendi lähenemisest nelja elektroniga π-süsteemile, kasutades piirmolekuliorbitaale. Pöörlemine on disrotatsiooniline, kui väike molekul läheneb lineaarselt, ja konrotatsiooniline, kui molekul läheneb mittelineaarselt. Disrotatoorne ja konrotatoorne ütlevad, kuidas π-süsteemi sidemed pöörlevad. Disrotatoorne tähendab vastassuunalist, samas kui konrotatoorne tähendab ühesugust suunda. Seda näitab ka alljärgnev diagramm.
Kasutades Huckeli reeglit, saab öelda, kas π-süsteem on aromaatne või antiaromaatiline. Kui see on aromaatne, kasutatakse lineaarsetes lähenemisviisides disrotatsioonilist liikumist, samas kui mittelineaarsetes lähenemisviisides kasutatakse konrotatsioonilist liikumist. Antiaromaatilise süsteemi puhul on vastupidi. Lineaarsete lähenemisviiside puhul kasutatakse konrotatsioonilist liikumist, mittelineaarsete lähenemisviiside puhul aga disrotatsioonilist liikumist.
Keletroopilised reaktsioonid, milles osalevad SO2
Termodünaamika
Kui vääveldioksiid reageerib butadieeni ja isopreeniga, tekib kaks erinevat toodet. Reaktsioonimehhanism kontrollib, mis tekib. Võimalikud on nii kineetiline kui ka termodünaamiline toode. Termodünaamilist toodet tekib rohkem kui kineetilist toodet. Kineetiline toode tekib Diels-Alderi reaktsioonis, samas kui keletroopiline reaktsioon tekitab termodünaamiliselt stabiilsema toote. Keletroopilist reaktsiooni kasutatakse rohkem, sest see tekitab stabiilsema viieliikmelise rõnga adukti. Allpool esitatud skeem näitab kahe toote erinevust. Vasakul asuv tee näitab termodünaamilist toodet, paremal asuv tee aga kineetilist toodet. Suarez ja Sordo näitasid seda 1995. aastal. Nad näitasid seda nii katsetega kui ka Gaussi arvutuste abil.
Kineetika
Üheks näiteks on 1,3-dieenide ketroopilised reaktsioonid vääveldioksiidiga. Keemikud on hoolikalt uurinud selle reaktsiooni kineetikat. Isaacs ja Laila mõõtsid 1976. aastal vääveldioksiidi liitumise keneetilisi tegureid butadieeni derivaatidele. Liitumise kiirust jälgiti benseenis 30 °C juures, kui dieeni algne ülejääk oli kahekümnekordne. Nad kasutasid spektrofotomeetrit, et uurida valgust 320 nm juures, et mõõta SO2 kadumist. Reaktsioon näitas "pseudo esimese korra kineetikat". Keemikud leidsid, et dieenil olevad elektroni tõmbavad rühmad vähendasid reaktsiooni kiirust. Samuti mõjutas reaktsioonikiirust oluliselt 2-substituentide steriiline mõju, kusjuures mahukamad rühmad suurendasid reaktsiooni kiirust. (Teisisõnu, mida suurem oli teise süsiniku aatomi küljes rippuvate aatomite rühm, seda kiiremini kulges reaktsioon). Autorid seostavad seda mahukate rühmade kalduvusega soodustada dieeni tsisoidset konformatsiooni, mis on reaktsiooni jaoks oluline (vt tabel allpool). Lisaks mõõdeti seitsme dieeni puhul kiirused neljal temperatuuril. Nende mõõtmiste põhjal kasutasid keemikud Arrheniuse võrrandit, et arvutada iga reaktsiooni aktiveerimisentalpia (ΔH‡) ja aktiveerimisentroopia (ΔS‡). See oli üks esimesi olulisi katseid, mille eesmärk oli uurida keletroopilise reaktsiooni keneetikat.
| -Butadieen | 104 k /min−1 (30 °C) (± 1-2%) absoluutne | 104 k /min−1 (30 °C) (± 1-2%) suhteline | ΔH‡ /kcal mol−1 | ΔS‡ /cal mol−1 K −1 |
| 2-metüül | 1.83 | 1.00 | 14.9 | -15 |
| 2-etüül | 4.76 | 2.60 | 10.6 | -20 |
| 2-isopropüül | 13.0 | 7.38 | 12.5 | -17 |
| 2-tert-butüül | 38.2 | 20.8 | 10.0 | -19 |
| 2-neopentüül | 17.2 | 9.4 | 11.6 | -18 |
| 2-cloro | 0.24 | 0.13 | EI KOHALDATA | EI KOHALDATA |
| 2-bromoetüül | 0.72 | 0.39 | EI KOHALDATA | EI KOHALDATA |
| 2-p-tolüül | 24.7 | 13.5 | 10.4 | -19 |
| 2-fenüül | 17.3 | 9.45 | EI KOHALDATA | EI KOHALDATA |
| 2-(p-bromofenüül) | 9.07 | 4.96 | EI KOHALDATA | EI KOHALDATA |
| 2,3-dimetüül | 3.54 | 1.93 | 12.3 | -18 |
| cis-1-metüül | 0.18 | 0.10 | EI KOHALDATA | EI KOHALDATA |
| trans-1-metüül | 0.69 | 0.38 | EI KOHALDATA | EI KOHALDATA |
| 1,2-dimetüleen-tsükloheksaan | 24.7 | 13.5 | 11.4 | -16 |
| 2-metüül-1,1,4,4,4-d4 | 1.96 | EI KOHALDATA | EI KOHALDATA | EI KOHALDATA |
Monnat, Vogel ja Sordo mõõtsid 2002. aastal vääveldioksiidi liitumise kineetikat 1,2-dimetülideentsükloalkaanidele. Nad kirjutasid, et 1,2-dimetülidentsükloheksaani reaktsioon vääveldioksiidiga võib sõltuvalt reaktsioonitingimustest anda kaks erinevat toodet. Kineetilise kontrolli all (≤ -60 °C) tekib vastavat sultiini hetero-Diels-Alderi reaktsiooni kaudu, kuid termodünaamilise kontrolli all (≥ -40 °C) tekib vastavat sulfoleeni keletroopilise reaktsiooni kaudu. Hetero-Diels-Alderi reaktsiooni aktiveerimisentalpia on umbes 2 kcal/mol väiksem kui vastava keletroopilise reaktsiooni puhul. Sulfoleen on CHCl/SO222 lahuses umbes 10 kcal/mol stabiilsem kui isomeetriline sultiin.
Autorid suutsid eksperimentaalselt välja töötada 1,2-dimetülidentsükloheksaani ja vääveldioksiidi reaktsiooni kiiruse seaduse 261,2 K juures, et saada vastav sulfoleen. Reaktsioon oli 1,2-dimetülidentsükloheksaani puhul esimese järjekorra, kuid vääveldioksiidi puhul teise järjekorra (vt allpool). See kinnitas teoreetiliste keemikute prognoosi, mis põhines kõrgetasemelistel ab initio kvantarvutustel. Kasutades arvutusmeetodeid, pakkusid autorid välja 1,2-dimetülidentsükloheksaani ja vääveldioksiidi vahelise keletroopilise reaktsiooni üleminekustruktuuri (vt joonis paremal). Reaktsioon on vääveldioksiidiga teise järjekorra, sest tõenäoliselt seondub üleminekusseisundiga veel üks vääveldioksiidi molekul, mis aitab seda stabiliseerida. Sarnased tulemused saadi 1995. aasta uuringus, mille tegid Suarez, Sordo ja Sordo, kes kasutasid ab initio arvutusi, et uurida vääveldioksiidi ja 1,3-dieenide reaktsiooni kineetilist ja termodünaamilist kontrolli.
d [ ]3 d t = k [2 ]1 [ S O ] 2{\displaystyle2 {\frac {d[3]}{dt}}=k_{2}[1][SO_{2}]^{2}}}
Lahusti mõju
Lahusti mõju 3,4-dimetüül-2,5-dihüdrotiofen-1,1-dioksiidi (paremal kujutatud) keletroopilise reaktsiooni kineetiliselt uuriti 14 lahustis. Leiti, et reaktsiooni kiiruskonstandid ja tasakaalukonstandid on lineaarselt korrelatsioonis ET(30) lahusti polaarsuse skaalaga.
Reaktsioonid toimusid 120 °C juures ja neid uuriti reaktsioonisegu 1H-NMR-spektroskoopiaga. Leiti, et edastuskiirus k1 väheneb tsükloheksaanilt metanoolile üleminekul 4,5 korda. Leiti, et pöördkiirus k-1 suureneb 53 korda tsükloheksaanilt metanoolile üleminekul, samas kui tasakaalukonstant K eqvähenes 140 korda. On oletatud, et aktiveerimisprotsessi käigus toimub polaarsuse muutus, mida tõendavad tasakaalu- ja kineetiliste andmete vahelised seosed. Autorid väidavad, et reaktsiooni näib mõjutavat lahusti polaarsus ja seda saab näidata dipoolmomendi muutusega, kui minnakse reaktandist ülemineku olekusse tooteni. Samuti väidavad autorid, et keletroopilist reaktsiooni ei näi mõjutavat ei lahusti happesus ega aluselisus.
Selle uuringu tulemuste põhjal ootavad autorid järgmist käitumist:
1. Lahusti polaarsuse muutus mõjutab kiirust vähem kui tasakaal.
2. Kiiruskonstandeid iseloomustab vastupidine mõju polaarsusele: k1 väheneb veidi ET(30) suurenemisel ja k-1 suureneb samades tingimustes.
3. Mõju k-le-1 on suurem kui k-le1.

1,2-dimetülidentsükloheksaani reageerimine SO-ga2 annab sultiini heterodiels-Alderi reaktsiooni kaudu kineetilise kontrolli all või sulfoleeni keletroopilise reaktsiooni kaudu termodünaamilise kontrolli all.

1,2-dimetülidentsükloheksaani ja SO2 ülemineku seisund, et saada sulfoleeni läbi koledroopilise reaktsiooni
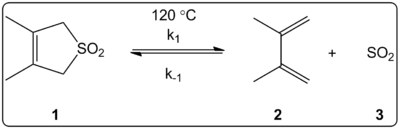
Erinevates lahustites uuritud ketroopiline reaktsioon
Karbeenide liitumised alkeenidega
Üks sünteetiliselt tähtsamaid keletroopilisi reaktsioone on singel-karbeeni liitmine alkeeniga, et saada tsüklopropaani (vt joonis vasakul). Karbeen on neutraalne molekul, mis sisaldab kahevalentset süsinikku, millel on kuus elektroni oma valentsuskoores. Seetõttu on karbenid väga reaktiivsed elektrofiilid ja tekivad reaktsiooni vaheproduktidena. Singlet-karbeen sisaldab tühja p-orbitaali ja ligikaudu 2sp-hübriidorbitaali, millel on kaks elektroni. Singlet-karbeenid liituvad stereospetsiifiliselt alkeenidega ja alkeeni stereokeemia säilib tsüklopropaanproduktis. Karbeeni liitumise mehhanism alkeenile on kooskõlastatud [2+1] tsükliliitumine (vt joonis). Kloroformist või bromoformist saadud karpeene võib kasutada CX2 lisamiseks alkeenile, et saada dihalotsüklopropaani, samas kui Simmons-Smithi reaktiiv lisab CH2.
Täidetud karabeeni orbitaali vastastikmõju alkeeni π-süsteemiga loob nelja elektroniga süsteemi ja soodustab mittelineaarset lähenemist. Samuti on soodne karabeeni tühja p-orbitaali segunemine täidetud alkeeni π-orbitaaliga. Soodne segunemine toimub mittelineaarse lähenemise kaudu (vt joonis 2 paremal). Kuigi teooria eelistab selgelt mittelineaarset lähenemist, ei ole siiski ilmseid eksperimentaalseid tagajärgi lineaarse vs. mittelineaarse lähenemise kohta.

Karbeeni liitmine alkeeniga tsüklopropaani moodustamiseks

Joonis 2. A) Singlet-karbeenide orbitaalid B) mitte-lineaarne lähenemine a) karbeeni sp-orbitaalile2 ja b) karbeeni p-orbitaalile
Küsimused ja vastused
K: Mis on tšeletroopiline reaktsioon?
V: Keletroopiline reaktsioon on peritsükliline reaktsioon, mille puhul üks aatom ühel reaktiivil saab kaks uut sidet.
K: Mis on peritsükliline reaktsioon?
V: Peritsükliline reaktsioon on reaktsioon, mis hõlmab aatomite tsüklilise massiivi ja sellega seotud interaktsionaalse orbitaalide tsüklilise massiivi ülemineku seisundit, milles toimub َ ja ً sidemete ümberorganiseerumine.
K: Mille poolest erineb see teist tüüpi reaktsioonidest?
V: Keletroopilised reaktsioonid on tsüklilisandite alamklass ja neid eristab teist tüüpi reaktsioonidest see, et ühel reaktiivil tekivad mõlemad uued sidemed sama aatomiga.
K: Millised on mõned näited?
V: Näidetena võib tuua "ketroopilised ekstrusioonid", näiteks kui karbooniumrühma üks aatom satub süsinikmonooksiidiks.
K: Mis juhib neid reaktsioone?
V: Nende reaktsioonide liikumapanevaks jõuks on sageli gaasi (nt CO või N2) vabanemisest tulenev entroopiline kasu.
K: Kas joonis 1 on seotud ketroopiliste reaktsioonidega? V: Jah, joonisel 1 on esitatud näiteid ketroopiliste reaktsioonide kohta.
Otsige
![{\displaystyle {\frac {d[3]}{dt}}=k_{2}[1][SO_{2}]^{2}}](https://www.alegsaonline.com/image/a02f69dd0783356fbf24499f57d0df29cd264f16.svg)