Geeniteraapia: määratlus, viirusvektorid ja Glybera-ravi
Geeniteraapia, viirusvektorid ja Glybera: selgitus, mehhanismid ja ELi heakskiit — kuidas toimib geenisiirdamine lipaasipuuduse raviks ja mida see patsientidele tähendab.
Geeniteraapia tähendab toimiva geeni sisestamist inimesele, kellel on kahjustatud geen. Euroopa Komisjon on selle meetodi heaks kiitnud ühe konkreetse ravi puhul. Ravim Glybera kasutab viirust, et nakatada lihasrakud toimiva geenikoopiaga. Euroopa Komisjon on andnud Glyberale müügiloa, mis tähendab, et seda võib müüa kogu ELis.
Ühel inimesel miljonist on rasvade lagundamiseks vajaliku lipaasigeeni kahjustatud koopia. Rasv koguneb nende veres; see põhjustab valu ja kõhunäärmepõletikku (pankreatiit). See on eluohtlik. Siiani on ainus viis selle haiguse ohjamiseks väga madala rasvasisaldusega toitumine.
Sellisel viisil kasutatuna on viirus vektor. See tähendab, et see on kandja; geen on sisestatud viiruse genoomi ja viirus kleebib selle inimese rakkudesse. Seda tehnikat nimetatakse transfektsiooniks. See tehnika erineb geenide väljaütlemise tehnikast, mille puhul ei kasutata viirusvektorit.
Glybera — konkreetse haiguse raviks loodud geeniteraapia
Glybera (alipogene tiparvovec) oli maailma üks esimesi heaks kiidetud geeniravimeid, suunatud harvaesineva lipoproteiini lipaasi puudulikkuse (LPL-defitsiit) raviks. Ravimi toimepõhimõte on sisestada toimiv lipaasigeen lihasrakkudesse, et taastada või suurendada lipaasi tootmist ja vähendada veres olevate rasvade taset. Seda tehti tavaliselt intramuskulaarsete süstidega valitud lihasekulgudesse.
Milline viirusvektor kasutati ja miks
Adeno-assotsieerunud viirus (AAV) – Glybera puhul kasutati AAV1 serotüüpi. AAVid on populaarne valik, sest neil on mitmeid eeliseid: nad nakatavad rakkusid efektiivselt, tekitavad tavaliselt vähem patoloogilist immuunvastust kui paljud teised viirused ning nende risk juhuslikuks genoomi sissetulekuks (insertional mutagenesis) on madalam kui mõnel teisel klassikalisel vektoril. Samas ei ole AAVid täielikult riskivabad — olemas on immuunvastuse ja eelnevate antikehadega seotud piirangud, mis võivad vähendada ravi efektiivsust.
Ohud, piirangud ja regulatsioon
- Ohud: võimalikud kõrvaltoimed hõlmavad lokaalset põletikku süstekohal, süsteemset immuunvastust, ning harvemini tõsisemaid reaktsioone. Geneetilise materjali püsiv integreerumine on AAVide puhul harvem kui retroviiruste puhul, kuid täielikku riskivabadust see ei taga.
- Püsivus: sõltuvalt vektorist ja koest võib geeni väljund olla ajutine või püsiv — lihasrakus võib ekspressioon kesta aastaid, kuid mõnel juhul väheneb see aja jooksul.
- Piirangud: kõrged kulud ja spetsiifilised patsiadikriteeriumid vähendavad ravi laialdast kasutust.
- Regulatsioon: geeniravi heakskiit ja järelvalve on ranged. Euroopas andis Euroopa Komisjon turustusloa Glyberale, kuid arvestatakse pikajalist jälgimist ja riskide hindamist.
Tulemused ja edasised arengud
Glybera näitas, et somaatiline geeniteraapia võib ravida pärilikke ainevahetushaigusi, kuid praktilised ja majanduslikud takistused olid olulised: ravimi hind oli väga kõrge ja patsientide arv väike, mistõttu tootja hiljem turult taastus. See kogemus on siiski avanud teed edasistele geeniravidele ja arendanud edasi vektorite ning tarneviiside teadust.
Tulevik
Tulevikus oodatakse parandusi viirusvektorites (parem sihtimine, väiksem immuunvastus), samuti mitteviiruslikes tarnekanalites (nt lipiidnanosoomid) ja täpsemates geneetilises redigeerimises (nt CRISPR/Cas-põhised lähenemised). Oluline on jätkuv ohutus- ja tõhususkontroll, eetilised arutelud (eriti eraldades somaatilise ja germline-ravi) ning ligipääsetavuse küsimused, et need uuendused jõuaksid laiemalt patsientideni.
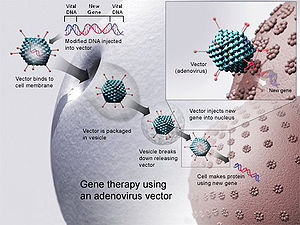
Geeniteraapia adenoviirusvektori abil. Uus geen pannakse viirusesse, mis seejärel pannakse inimesele. Kui ravi on edukas, toodab uus geen toimiva ensüümi, mis ravib haigust.
Hiina
Hiina oli esimene riik, mis kiitis 2003. aastal heaks geeniteraapia kaubandusliku tootmise. See geeniteraapia on mõeldud pea ja kaela lamerakk-kartsinoomi (HNSCC) raviks - vähk, mida esineb 10% uutest vähivormidest Hiinas. Hiinas on igal aastal 2,5 miljonit uut vähihaiget.
Kaubamärgi Gendicine all müüdav maailma esimene kaubanduslik geeniteraapia kasutab samuti viirust, et sisestada geen inimese genoomi.
Past
Geeniteraapia võimalikkusest hakati rääkima kohe, kui DNA ja RNA roll oli teada. Esimene konkreetne väljaanne ilmus 1972. aastal.
Tulevane
Paljud teised geeniteraapia liigid on katsejärgus. On selge, et tulevase kliinilise meditsiini osaks on sündmuste tsükkel: DNA järjestuse analüüs > defektsete geenide tuvastamine > geenide parandamine geeniteraapia või geenide välja lülitamise abil. Mõnikord esineb probleeme kõrvaltoimetega; need võivad avaneda uuringufaasis. Praegu on olemas andmebaas, kus on loetletud kõik teadaolevad kliinilised uuringud.
Küsimused ja vastused
K: Mis on geeniteraapia?
V: Geeniteraapia on protsess, mille käigus sisestatakse toimiv geen, et asendada patsiendi kahjustatud geen.
K: Millise toote on Euroopa Komisjon geeniteraapia jaoks heaks kiitnud?
V: Euroopa Komisjon on geeniteraapia jaoks heaks kiitnud toote Glybera.
K: Kuidas ravib Glybera geenihäireid?
V: Glybera kasutab viirust, et nakatada lihasrakke geenide toimiva koopiaga, et ravida geneetilist häiret.
K: Mis on lipaasi geen ja miks on see oluline?
V: Lipaasi geen on geen, mida on vaja rasvade lagundamiseks. See on oluline, sest selle geeni kahjustatud koopiad võivad põhjustada rasva kogunemist veres, mis viib eluohtliku pankreatiidi tekkimiseni.
K: Millist tehnikat kasutab Glybera geeniteraapia puhul?
V: Glybera kasutab transfektsioonitehnikat, kus viirusvektor kleebib geeni inimrakkudesse.
K: Mis on viirusvektor?
V: Viirusvektor on kandja, mis kannab geneetilist materjali rakkudesse.
K: Mille poolest erineb transfektsioonitehnika geenide väljaütlemise tehnikast?
V: Transfektsioonitehnika hõlmab viirusvektori kasutamist geeni toimiva koopia sisestamiseks, samas kui geenide välja lülitamise tehnika ei kasuta viirusvektorit. Geeni knockout-tehnika eesmärk on geeni eemaldamine või välja lülitamine.
Otsige